TREM2: ¿amigo o enemigo?
La enfermedad de Alzheimer, la forma más común de demencia en los ancianos, es un trastorno neurodegenerativo que se caracteriza por una pérdida lenta pero progresiva de la función cognitiva. Placas amiloides extracelulares, ovillos neurofibrilares intracelulares, y la pérdida de neuronas y sinapsis que resulta en la atrofia cerebral son las principales características patológicas de la condición. El inicio se da por lo general a partir de los 70 años de edad, aunque la prevalencia aumenta exponencialmente después de los 65 años y supera el 25% en los mayores de 90.
La gran mayoría de las variantes génicas en la secuencia del genoma que afectan notablemente el riesgo de la enfermedad de Alzheimer son variantes raras, estas parecen ser totalmente penetrantes y gatillar un inicio temprano de la enfermedad, en la mayoría de los casos antes de los 60 años. Sin embargo, estas variantes no arrojan luz sobre la forma más común, de inicio tardío. Por cuanto, la investigación se ha centrado en dilucidar los genes y sus variantes que podrían estar involucrados en este tipo de demencia.
TREM2 y el riesgo de Alzheimer
La enfermedad de Alzheimer es un trastorno genéticamente complejo y heterogéneo. Estudios de asociación genómica dirigidos a identificar variantes génicas que influyan en el riesgo de la condición han implicado varios genes de inmunidad innata, incluyendo los de activación microglial, neuroinflamación y del péptido beta-amiloide 42 (Aß-42). Por ejemplo, uno de estos genes, CD33, codifica una proteína que, cuando se activa en la microglia, inhibe la captación y degradación microglial de Aß-42, promoviendo así las características patológicas de Aß-42, que se caracterizan por la acumulación de péptidos Aβ- 42 en las placas. Los ovillos neurofibrilares, parcialmente formados por la proteína tau hiperfosforilada, constituyen otra característica prominente de la enfermedad.
El receptor de activación expresado en las células mieloides 2 (TREM2), es un receptor inmune innato que se expresa en la superficie de las células mieloides, tales como monocitos, macrófagos y microglia en el cerebro. Se ha visto que mutaciones homocigóticas en el gen TREM2 pueden conducir a una forma de demencia conocida como enfermedad de Nasu-Hakola, que a menudo implica frecuentes quistes óseos y fracturas. Una de estas mutaciones, R47H, también confiere un mayor peligro de Alzheimer de aparición tardía cuando está en estado heterocigótico.
Taylor R. Jay y colaboradores (J Exp Med 2015; 212: 287-95) recientemente encontraron que los niveles de expresión de TREM2 estaban sobre regulados en células mieloides que se acumulan alrededor de las placas Aß en dos modelos de ratón para la enfermedad de Alzheimer y en tejido cerebral de personas con la patología. Ellos observaron que TREM2 se expresa específicamente en un tipo de macrófagos procedentes de monocitos periféricos que infiltran el parénquima cerebral. También detectaron TREM2 en macrófagos CD45+ que rodean a placas de Aß, y no en la microglía residente. Curiosamente, el silenciamiento de TREM2 en un modelo específico de ratón (APP/PS1) conduce a una dramática reducción de macrófagos asociados a Aß, sin observarse cambios en la microglia residente (figura 1A). Estos animales deficientes en TREM2 también tenían menos inflamación cerebral y astrocitosis, menos placas Aß en el hipocampo y una menor hiperfosforilación de la proteína tau, en comparación a ratones APP/PS1 con TREM2 intacto. Tales resultados sugieren que los macrófagos TREM2+ contribuyen a las características patológicas de la enfermedad de Alzheimer.
Los anteriores resultados contrastan con los obtenidos por otros grupos de investigación que han determinado que el silenciamiento de TREM2 exacerba la enfermedad, con aumento de placas Aß en el hipocampo debido a una respuesta disfuncional de la microglia. La deficiencia de TREM2 también conduce a una reducción marcada en la microglía residente alrededor de las placas Aß, lo que sugiere que esto afecta negativamente su capacidad para rodear y limpiar las placas Aß (figura 1B).
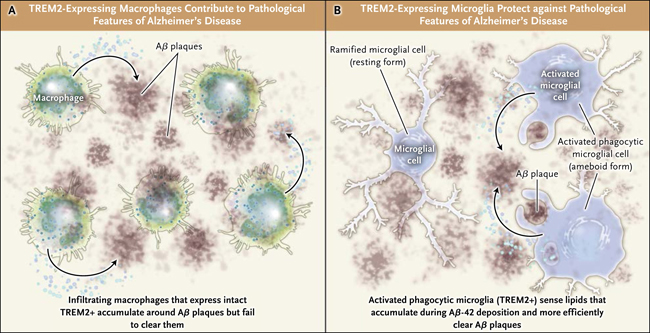
Figura 1: diferentes formas de TREM2
No está claro cómo una variante de TREM2 confiere susceptibilidad a la enfermedad de Alzheimer. Los experimentos con el uso de modelos de ratón indican diferentes mecanismos potenciales. Se ha encontrado que la infiltración de macrófagos en el cerebro (TREM2+ y CD45+) se acumula alrededor de las placas beta-amiloide (Aß) pero no logra eficientemente eliminarlas, es decir, los macrófagos que expresan TREM2 pueden contribuir a las características patológicas de la enfermedad. En contraste, también se ha observado que la microglia TREM2+, residente en el cerebro, percibe a los lípidos que se acumulan durante la deposición Aß-42 y por lo tanto limpia de forma más eficiente las placas patológicas.
También en apoyo a esta conclusión están los resultados de una investigación que demuestra que TREM2 está altamente expresado en la microglía residente en ratones de tipo salvaje. Otros autores han encontrado que la parte de TREM2 que emerge desde la superficie celular es escindida por una proteasa y que sus niveles solubles disminuyen en el líquido cefalorraquídeo de pacientes con Alzheimer y demencia frontotemporal. Estos hallazgos sugieren, además, que la función de TREM2 comprometida aumenta el riesgo de estas dos formas de demencia. Igualmente se ha podido registrar que TREM2 reconoce una amplia gama de lípidos que se acumulan durante la deposición de Aß y que la mutación R47H perjudica el reconocimiento de ligandos de lípidos, sugiriendo que TREM2 puede ser un sensor microglial de lípidos asociados a daño y regular una respuesta microglial protectora en la enfermedad de Alzheimer. Juntos, estos resultados sugieren que TREM2 más la microglia tienen un papel beneficioso en pacientes con Alzheimer.
Por lo tanto, diferentes ensayos muestran efectos opuestos de la ablación de TREM2 en la neuroinflamación y la carga de placas Aß en el hipocampo durante la patogénesis de la enfermedad de Alzheimer. Estos resultados disímiles podrían deberse a la utilización de varios modelos de ratón para la enfermedad d y el silenciamiento de TREM2, así como a los análisis realizados en diferentes puntos temporales. En cualquier caso, se ha demostrado previamente que TREM2 juega un papel importante en la limpieza de neuronas lesionadas y moribundas, lo que podría sugerir un mecanismo común para su función en diversos trastornos neurodegenerativos, tales como la enfermedad de Alzheimer, la demencia frontotemporal, la enfermedad de Parkinson y la esclerosis lateral amiotrófica. La investigación futura debería proporcionar una mejor comprensión de la acción de TREM2 en las células microgliales y desarrollar nuevas terapias para la prevención y tratamiento del Alzheimer y de otros trastornos neurodegenerativos.
Fuente bibliográfica
TREM2 and Risk of Alzheimer’s Disease — Friend or Foe?
Rudolph E. Tanzi, Ph.D.
Harvard Medical School and Massachusetts General Hospital — both in Boston.
DOI: 10.1056/NEJMcibr1503954


