Transformación en el tratamiento de la fibrosis quística
Gracias a los avances en la comprensión genética y el desarrollo de moduladores específicos, la esperanza y calidad de vida de los pacientes que la padecen ha mejorado notablemente, aunque aún existen retos por superar.
La fibrosis quística (FQ) es una enfermedad genética letal descrita inicialmente en 1938 por Dorothy Andersen, caracterizada por fibrosis pancreática, formación de quistes y bronquiectasias debido a secreciones espesas que obstruyen las vías respiratorias. Con el tiempo, se ha reconocido que la FQ es una exocrinopatía generalizada que afecta múltiples tejidos epiteliales. Si bien los tratamientos paliativos prolongaron la vida de los pacientes, el mecanismo patogénico permaneció desconocido durante décadas. En 1989, se identificó el gen "causal", CFTR, que codifica el regulador de la conductancia transmembrana de la fibrosis quística (CFTR), marcando un hito crucial.
Con el tiempo, Michael Welsh, Jesús González y Paul Negulescu, investigadores de EE. UU., dilucidaron la patogénesis, impulsaron la ciencia farmacéutica en nuevas y notables direcciones y proporcionaron una terapia transformadora para la enfermedad. Sus logros han sido reconocidos con el Premio Lasker-DeBakey de Investigación Médica Clínica 2025.
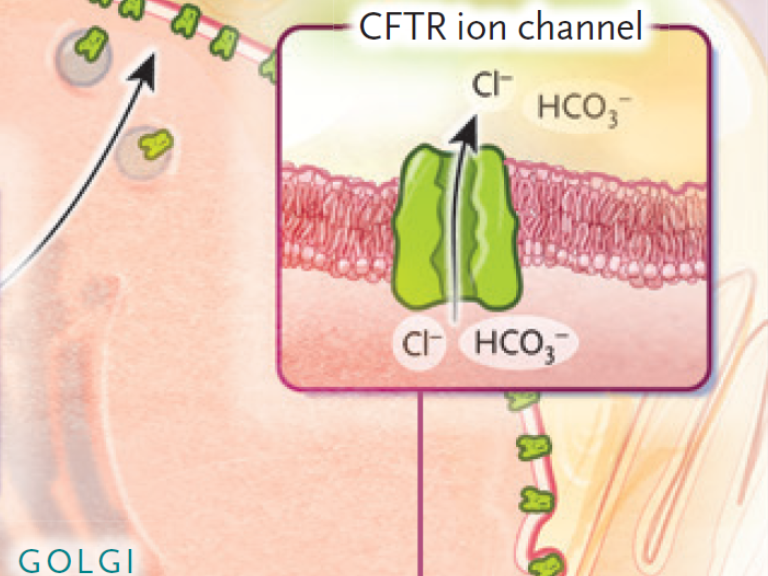
El descubrimiento de que CFTR regula la permeabilidad aniónica en el epitelio de las vías respiratorias fue fundamental. Posteriormente, se determinó que funciona como un canal de cloruro, a pesar de su estructura atípica. Se identificaron cientos de variantes asociadas con la enfermedad, clasificándose según el tipo de disfunción. Se demostró que la variante más común, F508del, causa un defecto de biogénesis, donde la proteína CFTR mal plegada es degradada (figura 1).
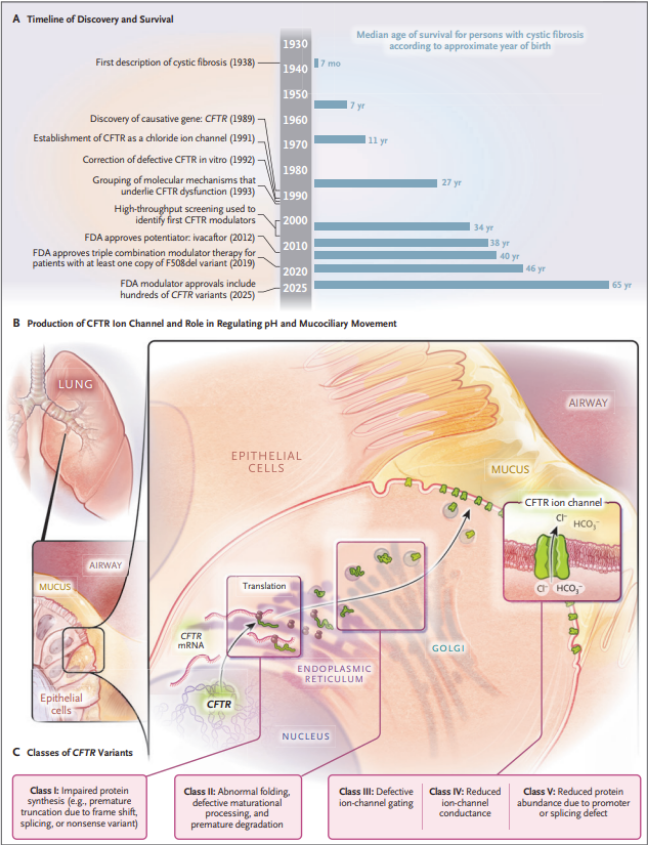
Figura 1: Avances en la comprensión y el tratamiento de la fibrosis quística
Se buscó identificar fármacos que pudieran reparar la proteína CFTR mutante, lo cual representó un desafío científico significativo. Mediante el cribado de bibliotecas de compuestos, se logró evaluar miles de fármacos candidatos para reparar CFTR defectuoso. Se identificó un potenciador llamado ivacaftor, que funcionaba para abordar un defecto de compuerta del canal iónico causado por la mutación G551D. El tratamiento con ivacaftor resultó en una dramática disminución de los niveles de cloruro en sudor y mejoría de la función pulmonar. A este avance le siguió el descubrimiento de moléculas como lumacaftor, elexacaftor y tezacaftor, que corrigen la biogénesis anormal de CFTR F508del.
Se ha demostrado que los moduladores de CFTR ejercen alostería inesperada. En pacientes con la variante F508del, se requieren tres fármacos con efectos complementarios en el plegamiento de CFTR. Se han aprobado fármacos dirigidos a más de 250 variantes del gen. Sin embargo, aún existen desafíos como la falta de respuesta a los moduladores en algunos pacientes, efectos adversos inaceptables, la incapacidad de pagar la terapia o variantes que provocan el término prematuro de la traducción.
El campo de la fibrosis quística sigue trabajando para superar los desafíos actuales, con moléculas de nueva generación, enfoques basados en nucleótidos (edición y transferencia de genes) y otras estrategias. La esperanza de vida de las personas con la enfermedad ha aumentado considerablemente gracias a los avances, y se espera que siga aumentando a medida que los moduladores se administren a edades más tempranas.
Fuente bibliográfica
Transformative Research in Cystic Fibrosis
Eric J. Sorscher, M.D.
Emory University School of Medicine & Children’s Healthcare of Atlanta, Atlanta
N Engl J Med 2025; 393:1231-1234