Proteína p53: entre protectora y maligna
Investigaciones recientes sugieren que no solamente la inactivación de p53 es causa común para el desarrollo de tumores, sino que mutaciones específicas en el gen TP53 codificante para esta proteína, contribuirían a la obtención de nuevas funciones proteicas que estarían relacionadas con la generación del cáncer. Por otro lado el descubrimiento de genes codificantes de enzimas modificadoras de histonas y la relación con el nivel de expresión génica, se encuentra entre los blancos de ciertas formas mutantes de p53, lo cual revelaría cómo esas modificaciones pueden causar tal patología, más allá de la inactivación de p53.
P53 mutante y la regulación de la cromatina
Las mutaciones en el gen supresor de tumores TP53 son comunes en humanos. Aunque esas mutaciones inactivan invariablemente la actividad normal de p53, que es el factor de transcripción codificado por TP53, algunas mutaciones también dotan a p53 con “ganancias de función” que promueven el cáncer. Si es que las diversas mutaciones en p53 producen actividades de ganancia de función similares y cómo lo hacen, sigue siendo un enigma, pero encontrar la respuesta podría permitir el diseño de estrategias para tratar muchos tipos de cáncer. En una publicación de Jiajun Zhu y colaboradores (http://dx.doi.org/10.1038/nature15251 (2015)), dieron una posible explicación: la investigación mostró que las nuevas funciones de la proteína p53 mutante inducen la producción de enzimas que modifican las proteínas histonas en las que el ADN está empacado como cromatina, por lo tanto alterando la expresión génica.
Experimentalmente, modificando la expresión de la proteína p53 mutante de funciones adicionales, se observó que se afectan una gran cantidad de genes, potenciando la invasividad y proliferación de células tumorales in vitro. Por otra parte, ratones portadores de mutaciones clave para la ganancia de función en TP53, desarrollan tumores que difieren de aquellos en los que p53 no está presente. La disminución del nivel de actividad de esta proteína anómala, tiene efectos anti-proliferativos in vitro y puede reducir la metástasis o gatillar regresión tumoral in vivo. Por lo tanto, es deseable una mejor comprensión de esos mutantes. Los autores encontraron que en líneas celulares cancerígenas humanas, las formas mutantes de p53 se unen a regiones diferentes del ADN comparado con la proteína normal. En particular, las proteínas mutantes se unen a los genes MLL1 y MLL2. La proteína p53 mutante de funciones adicionales, parecer ser reclutada hacia esos genes, en parte a través de la unión a ETS2 — un factor de transcripción que se sabe que es capaz de unirse a p53 y dirigirse hacia genes diferentes respecto a los que se activan en condiciones normales de la proteína.
MLL1 y MLL2 son miembros de una familia enzimática de histonas metil-transferasas. Actúan como parte de un gran complejo para la modulación de la expresión génica, mediante la adición de grupos metilo a residuos aminoacídicos de lisina (K4) de histona H3. Esta metilación en la histona (H3K4) permite aumentar la transcripción del gen empacado alrededor de las histonas. En el trabajo anteriormente citado, se encontró que la ganancia de función de p53 también activa la expresión del gen MOZ, el que codifica una enzima que agrega grupos acetilo al residuo K9 de H3, nuevamente permitiendo una activación de la expresión génica.
En concordancia con la idea de que la ganancia de función de p53 afecta la modificación de histonas, al reducir los niveles de p53 mutante, se disminuye la acetilación de H3K9. Sin embargo, la reducción de p53, solo tiene un pequeño efecto sobre la metilación de H3K4. Quizás, esto se debe a que otros miembros de la familia metil-transferasas tienen roles similares a MLL1 y MLL2 pero independientes de p53. Zhu y colaboradores demostraron que la ganancia de función de p53 activa MLL1, MLL2 y MOZ y además mostraron que esta activación es parcialmente responsable de la capacidad de p53 mutante de potenciar la proliferación celular in vitro (figura1).
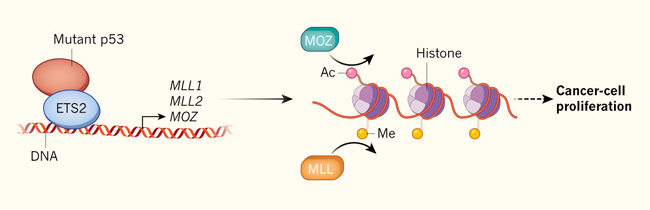
Figura 1: ganancia sobre p53
Las mutaciones de “ganancia de función” en el gen supresor de tumores TP53, permiten al factor de transcripción que codifica, unirse a blancos anormales, conduciendo al cáncer. Zhu y colaboradores mostraron que las ganancias funcionales de p53 permiten unirse al factor transcripcional ETS2, activando a los genes MLL1, MLL2 and MOZ. Los dos primeros codifican enzimas que agregan grupos metilo a las histonas alrededor de los genes se encuentran empacados como cromatina. Por su parte MOZ codifica para enzimas que añaden grupos acetilo a esas histonas. Ambas modificaciones aumentan la expresión génica local, posibilitando la proliferación de células cancerígenas a través de mecanismos aún desconocidos
Finalmente, la exploración de bases de datos de cáncer humano, proveyó de apoyo para esa investigación, indicando que la expresión de MLL1, MLL2 and MOZ está significativamente sobre-regulada en tumores con p53 mutante con funciones adicionales, comparada con la expresión en casos de ausencia de esta proteína o p53 normal. Esta correlación no es obvia entre los diferentes cáncer de mama, tejido que fue el origen de muchas líneas celulares estudiadas en esta investigación — aunque este trabajo mostró que tal correlación existe en las líneas celulares que utilizaron. Es probable que otras variables afecten la expresión de MLL en ciertos tipos tumorales. Como resultado esperado, será importante investigar los factores que determinan cuándo o si la ganancia funcional de p53 puede gatillar cambios en la expresión de MLL y MOZ, de forma de analizar los mecanismos subyacentes a esos eventos.
Las ganancias funcionales de p53 también mostraron ser capaces de participar en el complejo de remodelamiento de la cromatina SWI/SNF, sobre-regulando varios genes que pueden mediar por sí mismos las actividades causantes de cáncer por parte de la proteína anómala. Este descubrimiento, considerando los anteriores hallazgos relacionando a p53 con la cromatina y, por extensión al transcriptoma (perfil de expresión génico completo de la célula), podría explicar por qué tantos genes se ven afectados por la presencia de p53 con funciones adicionales. Pero precisamente cómo esta proteína con diversas mutaciones adquiere capacidades similares aún permanece sin ser resuelto.
Una posibilidad es que las p53 mutantes adopten estructuras diferentes a la proteína normal, lo que permita su interacción con ETS2. Sin embargo, no existe una explicación obvia para la evolución de tal interacción, y este modelo está en desacuerdo con la observación de que algunas proteínas con funciones adicionales tienen estructuras similares a las formas normales. Alternativamente, la capacidad de p53 normal de unirse a miles de sitios en el genoma humano podría prevenir de asociarse con los factores que la proteína anómala interacciona. O quizás la expresión de uno o más genes diana de alguna forma impide activamente a la proteína normal de participar en las interacciones características de la proteína mutante.
El vínculo entre p53 con funciones adicionales y MLL1 y MLL2 es intrigante, dado que miembros de la familia MLL presentan mutaciones frecuentemente en casos de cáncer. Por ejemplo, translocaciones cromosómicas que involucren a MLL1 pueden conducir al desarrollo de leucemia, mientras que mutaciones en MLL2 son comunes en varios carcinomas. Sin embargo las translocaciones eliminan el dominio metil-transferasa de MLL1, y las mutaciones en MLL2 parecer ser inactivantes. La explicación para esta aparente discrepancia con el trabajo de Zhu y colaboradores no está clara, pero probablemente refleja diferencias dependientes del contexto en la función enzimática.
¿Podrían servir estrategias que apunten a estos genes para tratar tumores que involucren a p53 y su adquisición de funciones? Hasta el momento se ha reportado que 2 inhibidores de la formación del complejo MLL bloquean la proliferación en células que expresan p53 mutante, pero sin afectar a células que carecen de p53. Eliminando esta proteína anómala o interfiriendo con su mecanismo de acción, se pueden lograr efectos anti-cancerígenos in vitro y en ratones. Por otra parte, hay mucho entusiasmo por los tratamientos de cáncer que afecten la modificación de cromatina, dando lugar a compuestos que apuntan a estas mismas actividades de remodelamiento, los que han sido aprobados para su uso clínico o están actualmente en ensayos de este tipo. Sin embargo, se requiere de mayor investigación al respecto, debido a que la especificidad de inhibidores de MLL no está totalmente establecida. Además, los genes MLL están activos durante el desarrollo embrionario y su inhibición puede causar su muerte, independiente de las mutaciones de TP53. Esas observaciones, junto con el hecho de que las mutaciones que interrumpen la función de MLL sean comunes en tumores, aumenta las preocupaciones que inhibidores de este complejo proteico puedan ser tóxicas o incluso promover tumores.
No obstante, dada la frecuencia con que TP53 presenta mutaciones en cáncer, los esfuerzos continuos para modular los efectos de p53 mutante se encuentran claramente justificados. Considerando como blancos a MLL y MOZ, terapias específicas podrían llegar a ser posibles. Por lo tanto, estos estudios podrían apuntar a tratamientos de tumores que contengan mutaciones en el gen TP53.
Fuente bibliográfica
Cancer: Mutant p53 and chromatin regulation
Carol Prives & Scott W. Lowe
Department of Biological Sciences, Columbia University, New York.
doi:10.1038/nature15212


