Presente y futuro de la resincronización cardíaca
Las arritmias son ritmos cardíacos irregulares causados por una variedad de razones, incluyendo la edad, daño al corazón, medicamentos y la genética. En pacientes con insuficiencia cardíaca o estimulación biventricular, la terapia de resincronización se usa para ayudar a mejorar el ritmo del corazón y los síntomas relacionados a la arritmia. El procedimiento consiste en la implantación de un marcapasos del tamaño de una moneda, por lo general justo debajo de la clavícula. Tres cables (conductores) conectados al dispositivo de seguimiento de la frecuencia cardíaca pueden detectar las irregularidades de ritmo, emitiendo pequeños pulsos de electricidad para que se corrijan. Esto es, "resincronizando" el corazón.
Debido a que el procedimiento mejora la eficiencia del órgano y aumenta el flujo sanguíneo, los pacientes han reportado el alivio de algunos sus síntomas característicos, como la falta de aliento. Los estudios clínicos también sugieren disminuciones de la hospitalización y la morbilidad, así como mejoras en la calidad de vida.
Mecanismos y conceptos para la terapia de resincronización cardíaca
La insuficiencia cardíaca sigue siendo una carga asistencial enorme, representando una de cada nueve defunciones en los Estados Unidos. Si bien ha mejorado considerablemente el pronóstico de los pacientes, también, desde hace mucho tiempo, se mantiene un dilema importantísimo. El tratamiento ideal de la condición debe mejorar la función cardíaca (en el corto y largo plazo) y los síntomas, así como el pronóstico. Desafortunadamente, los fármacos actuales que mejoran el pronóstico (por ejemplo, los inhibidores de la enzima convertidora de la angiotensina y los betabloqueadores) no optimizan la función y la sintomatología inicial (los betabloqueantes pueden incluso empeorarlos), y las drogas que sí mejoran estos parámetros (por ejemplo, las catecolaminas y los inhibidores de la fosfodiesterasa) en realidad empeoran el pronóstico a largo plazo. La notable excepción a esta regla es la terapia de resincronización cardiaca (TRC), en el que la estimulación biventricular restablece la coordinación de la contracción en pacientes con disincronía ventricular por bloqueo de la rama izquierda. Los ensayos han demostrado que la TRC es el único tratamiento de la insuficiencia cardíaca que mejora rápidamente la función y los síntomas, y reduce mortalidad a largo plazo. Probablemente los mecanismos beneficiosos alcancen más allá el solo hecho de restablecer la contracción sincrónica.
El estado contráctil de los cardiomiocitos se determina por la concentración de iones Ca2+ en torno a los miofilamentos, lo que es detectado por la troponina, que se une a los filamentos delgados (de actina) y sirve para regular el ciclo de puentes cruzados. Se han identificados importantes modificaciones postraduccionales como la modulación de este proceso: la fosforilación de residuos específicos de la troponina I cardíaca, la troponina T cardíaca, la miosina de cadena ligera reguladora 2, y la unión de la miosina cardíaca de la proteína C (fig. 1). La insuficiencia cardíaca va generalmente acompañada de cambios en el estado de fosforilación y la sensibilidad de los miofilamentos de Ca2+, que pueden contribuir a la progresión de la enfermedad.
El equipo de Jonathan A. Kirk y colaboradores (J Clin Invest 2013 December 2) describió recientemente una fuerte evidencia que los beneficios de la TRC tienen que ver con una mejora en la sensibilidad al Ca2+ de los miofilamentos e identificaron las posibles vías moleculares implicadas en este efecto. Los autores estudiaron un modelo de perro para la insuficiencia cardíaca (inducida por estimulación auricular rápida) y la asincronía ventricular (inducida por la ablación de la rama izquierda) y utilizaron la TRC para revertir la enfermedad. La insuficiencia cardíaca estuvo acompañada por una disminución de la sensibilidad de los miofilamentos de Ca2+, lo que fue restaurado por la TRC. Un hallazgo importante fue que los beneficios del tratamiento requieren la presencia de asincronía, para luego invertirla, en un modelo de insuficiencia cardíaca de contracción sincrónica (estimulación auricular rápida y sin la ablación de la rama izquierda), la sensibilidad Ca2+ fue tan afectada como lo fue en el modelo asincrónico antes de la TRC.
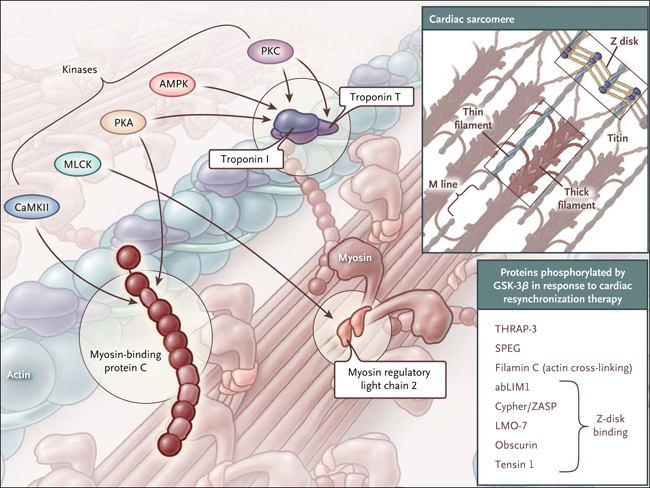
Figura 1: objetivos establecidos de la fosforilación de los miofilamentos y nuevos sustratos GSK-3β.
Se muestran las fosfoproteínas troponina I cardíaca, troponina T, miosina de cadena ligera reguladora 2 y la proteína C unida a miosina, y las quinasas responsables de su fosforilación. La glucógeno sintasa quinasa 3β recientemente identificada (GSK- 3β) se fosforila en respuesta a la terapia de resincronización cardíaca, principalmente por proteínas asociadas al disco Z. Entre otras, la abreviatura abLIM1 refiere a la proteína LIM 1 unida a actina.
La observación realizada por Jonathan A. Kirk y colegas que el uso de la proteína fosfatasa 1 disminuía la sensibilidad de los miofilamentos de Ca2+ en corazones tratados con TRC y en corazones control, sugiere fuertemente que el tratamiento mejora la función de los miofilamentos a través de la fosforilación. Es intrigante que la TRC no haya cambiado el estado de fosforilación de la fosfoproteínas miofilamentosas como la troponina I cardiaca, la troponina T cardíaca, la miosina de cadena ligera reguladora 2 y la proteína C de unión a la miosina cardíaca. Se utilizó la espectrometría de masa para investigar el fosfoproteoma miofibrilar, identificándose 13 proteínas con aumento de fosforilación inducida por la TRC. Los análisis de datos de secuencias sugirieron que los sitios eran fosforilados predominantemente por la glucógeno quinasa sintasa 3β (GSK-3β), un componente clave de la vía insulina-fosfoinositida 3-quinasa-Akt, que se activa en la TRC. Evaluaciones posteriores mostraban la fosforilación de sitios en ocho proteínas diferentes, la mayoría de las cuales asociadas a los discos o líneas Z, aumentadas por la TRC y modificadas in vitro por GSK-3β (fig. 1). El tratamiento in situ de GSK-3β de trabéculas aumentó la sensibilidad de los miofilamentos Ca2+ en la insuficiencia cardíaca disincrónica pero no tenía efecto sobre el control trabecular o en trabéculas tratadas previamente con TRC, una observación más de la implicación de la fosforilación por GSK-3β en la recuperación mediada por la TRC de la función de los miofilamentos. Por lo tanto, la investigación de Jonathan A. Kirk ha proporcionado pruebas sólidas para la recuperación de la función de los miofilamentos mediante TRC a través de la reactivación de GSK-3β.
El presente estudio se suma a la comprensión de los efectos de la TRC en el tratamiento de la insuficiencia cardíaca. Primero, proporciona algunos detalles de la huella molecular de sus beneficios, aunque al diseccionar las vías de señalización implicadas, es necesario aplicar los métodos utilizados en el análisis de la asincronía y la TRC en corazones de ratón, con el consiguiente “apagado” o sobreexpresión de GSK-3β. En segundo lugar, los resultados apoyan el concepto que los sensibilizadores de los miofilamentos Ca2+ son fármacos candidatos para el tratamiento de la insuficiencia cardíaca. Dichos agentes se encuentran actualmente en desarrollo, aunque ninguno aprobado para uso clínico. En tercer lugar, la GSK-3β es una diana prometedora para el tratamiento de la insuficiencia cardíaca, y los activadores de esta proteína podrían convertirse en una nueva forma de tratamiento. Finalmente, es interesante que la observación de un período previo sin disincronía parece ser necesario para que la TRC tenga un efecto beneficioso sobre la sensibilidad del Ca2+. Los autores sugieren que los pacientes con insuficiencia cardíaca sincronizada podrían beneficiarse de un período de asincronía (por ejemplo, inducida por estimulación ventricular derecha) y que los individuos sometidos al TRC a largo plazo se beneficiarían de los intervalos de tratamiento suspendido. Los estudios experimentales podrían probar si este enfoque es eficaz y, si lo es, podría determinarse el momento óptimo (duración y frecuencia) de períodos intermitentes de asincronía. Es probable, sin embargo, que este esquema no sea clínicamente aceptable debido al riesgo de descompensación durante períodos de disincronía inducida. Otra limitación de este estudio es que los resultados se obtuvieron en un modelo animal específico para la insuficiencia cardíaca inducida por estimulación rápida y asincronía inducida por ablación. Los seres humanos son mucho más heterogéneos, con un gran número de condiciones y con mayor frecuencia de insuficiencia cardíaca causada por cardiopatía isquémica o miocardiopatía, más que inducida por una taquicardia.
Fuente bibliográfica
New Mechanisms and Concept for Cardiac-Resynchronization Therapy
Stefan Neubauer, M.D., and Charles Redwood, Ph.D.
Division of Cardiovascular Medicine, Radcliffe Department of Medicine, University of Oxford, Oxford, United Kingdom.
DOI: 10.1056/NEJMcibr1315508


