Obesidad: de tal padre, tal hijo
El ADN es un factor determinante en nuestro peso, y se sabe que la obesidad se debe en gran medida a nuestros genes. Dicho esto, los efectos medioambientales, particularmente en los padres o durante el desarrollo temprano, también pueden afectar el peso corporal a través de cambios epigenéticos. Estas modificaciones se suelen heredar, a pesar de que no cambie el código genético.
Epigenética y obesidad
La prevalencia de la obesidad sigue aumentando a un ritmo alarmante, tanto en el mundo desarrollado como en los países en desarrollo. Esto es de gran preocupación no sólo por las consecuencias perjudiciales para la salud, sino que también porque los padres obesos son propensos a tener hijos obesos, perpetuando el ciclo de la obesidad.
Esta transmisión de fenotipo de padres a hijos es en parte consecuencia de los genes compartidos y del entorno. Sin embargo, también hay pruebas que la transmisión de la susceptibilidad a la obesidad puede ocurrir como consecuencia de "la programación del desarrollo". Este concepto sugiere que el ambiente dado en el momento de la concepción y durante la vida fetal y neonatal influye en la estructura, función y metabolismo de los órganos más importantes, lo que conduce a un aumento del riesgo de enfermedades tales como la diabetes tipo 2 y la enfermedad cardiovascular.
La evidencia para este tipo de programación de desarrollo proviene de estudios en mamíferos, que se han centrado inicialmente en la transmisión a través de la línea materna como consecuencia de la nutrición durante el embarazo. Sin embargo, la evidencia sugiere que la transmisión de rasgos, como el fenotipo para la obesidad por una dieta inducida, también puede ocurrir a través de la línea paterna. Se han propuesto mecanismos epigenéticos que influyen en la expresión de genes que median los efectos de la dieta materna y paterna sobre la susceptibilidad a la enfermedad en la descendencia (estos mecanismos incluyen alteraciones en la metilación del ADN, modificaciones de las histonas y la expresión de microARN).
Anita Ost y colaboradores (Cell 2014; 159:1352-64) acaban de describir un modelo de programación metabólica entre generaciones usando la Drosophila melanogaster (fig. 1). Moscas macho fueron alimentadas con una dieta definida de azúcar, que variaba de muy baja a muy alta. Las que ingerían concentraciones altas de azúcar durante 2 días antes del apareamiento tenían un aumento de triglicéridos tres veces superior que el nivel descrito al inicio del estudio. Estos machos fueron apareados con hembras y las crías F1 alimentadas con comida normal o una dieta obesógena alta en azúcar. No se observó ningún efecto de la dieta paterna en las moscas machos F1 bajo alimentación normal. Sin embargo, cuando los machos F1 eran alimentados con una dieta alta en azúcar, se observaba un efecto de la dieta paterna: la descendencia masculina F1 de padres que habían sido alimentados con una dieta baja o alta en azúcar tenían mayor contenido de triglicéridos. Estos datos son consistentes con la evidencia a partir de modelos de mamíferos que muestran que la nutrición subóptima en cada extremo del espectro (es decir, exceso de nutrición parental o desnutrición parental) provoca un aumento del riesgo de disfunción metabólica en la descendencia.
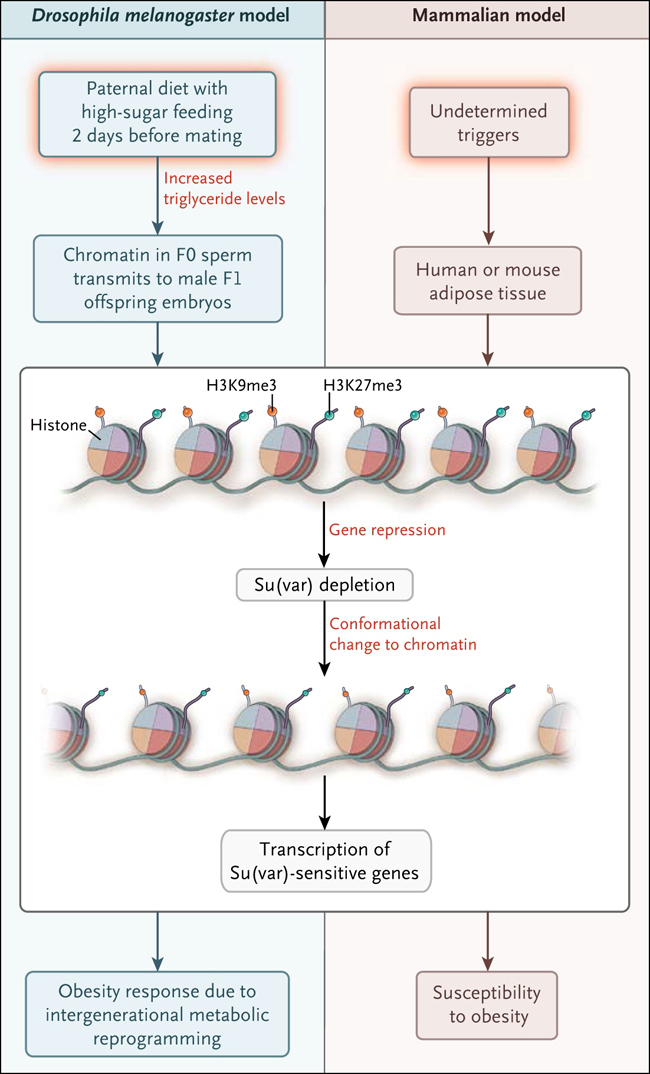
Figura 1: epigenética de la transmisión de la obesidad
Esta investigación observó que la obesidad puede ser transmitida de padres a hijos varones. Padres alimentados bajo una dieta con alto contenido de azúcar 2 días antes del apareamiento tenían niveles dramáticos de triglicéridos y daban origen a descendencia masculina con exceso de triglicéridos, de lípidos y de reservas adiposas, así como un aumento de peso corporal. Otros ensayos sugieren que los cambios a la cromatina en el esperma del padre representan el vehículo de una transmisión transgeneracional de fenotipo. Los datos apoyan la participación de varias proteínas modificadoras de la cromatina, como la Su(var), y un aumento general de la expresión génica en la progenie F1 afectada. Los análisis de tejido adiposo en ratones y humanos sugieren que un déficit de proteínas ortólogas modificadoras de cromatina se asocia a la obesidad en ratones y seres humanos. H3K9me3 denota trimetilación de la lisina 9 en la histona 3, y H3K27me3 trimetilación de la lisina 27 en la histona 3.
Una vez establecido que los cambios en la dieta paterna afectan el metabolismo en la descendencia en el modelo de D. melanogaster, los investigadores abordaron los posibles mecanismos a través de los cuales esto podrían ocurrir, centrándose en los efectos sobre la cromatina (complejo de ADN, ARN y proteínas que forma los cromosomas; cambios en la cromatina pueden afectar a la expresión génica). Ellos fueron capaces de utilizar la variación de la relación posición-efecto, un fenómeno genético que se puede utilizar como una lectura cuantitativa del estado de la cromatina y, por tanto, del silenciamiento transcripcional en loci cromosómicos específicos. Los autores encontraron un efecto de la alimentación con azúcar paternal en la estructura de la cromatina en una región específica del cromosoma X.
Otra prueba del impacto de la dieta paterna en la estructura de la cromatina viene de un análisis del transcriptoma de embriones generados a partir de padres alimentados con dietas altas en azúcar, revelando la desregulación de las transcripciones que codifican dos proteínas - uno de ellas llamada Su(var) - que están involucradas en la formación dinámica de la conformación cromosómica. Esta desregulación involucra una desregulación de las enzimas que modifican la estructura de la cromatina y la regulación de genes.
Al final de los experimentos, el grupo de Ost exploró la posibilidad de que cambios similares en la estructura de la cromatina se asociarían a la obesidad en mamíferos. El análisis de un conjuntos de datos obtenidos de tejido adiposo de individuos delgados y obesos, halló un agotamiento de las proteínas Su(var) en tres conjuntos de datos de seres humanos y en dos conjuntos de datos de ratones. Los de humanos se obtuvieron a partir de muestras de tejido adiposo de pares de gemelos monocigóticos, en el que uno de los gemelos era obeso y el otro de peso normal, lo que demuestra que el agotamiento de la vía SU(var) se asociaba con la obesidad en personas genéticamente idénticas. Este hallazgo es consistente con la posibilidad que el agotamiento de la vía SU(var) puede ser provocada por un “insulto” ambiental sobre el genoma que se asocia con la obesidad.
Los investigadores, por lo tanto, pudieron identificar una clara y conservada firma epigenética asociada a la obesidad a través de las especies. Ahora, los principales retos será establecer si el ambiente temprano puede modular esta firma epigenética en humanos y si la firma está presente antes del desarrollo fenotípico (es decir, la obesidad) y por lo tanto, poder ser utilizadas como un biomarcador de riesgo de la enfermedad. Para maximizar su potencial terapéutico, la especificidad de tejido de esta firma podría ser necesaria para utilización diagnóstica en la clínica. Una vez que esta falta de conocimiento se pueda subsanar, el uso de firmas epigenéticas para fines de diagnósticos podría convertirse en una posibilidad realista.
Fuente bibliográfica
Epigenetic Signatures of Obesity
Susan E. Ozanne, Ph.D.
Institute of Metabolic Science and the Medical Research Council Metabolic Diseases Unit, University of Cambridge, Cambridge, United Kingdom.
DOI: 10.1056/NEJMcibr1414707


