Nuevas células en viejos corazones
En los Estados Unidos, la insuficiencia cardíaca afecta a cerca de 6 millones de personas, con elevados costos en dinero cada año, transformándose en el diagnóstico más prevalente en las personas mayores de 65 años. A pesar de los enormes progresos logrados en el manejo de las enfermedades cardiovasculares, como por ejemplo, el infarto al corazón, muchos pacientes llegan a desarrollar secuelas tardías de la enfermedad, incluida la insuficiencia cardíaca y arritmias. Así, un número cada vez mayor de estos individuos representa una considerable carga y perjudican el logro de los objetivos médicos. También refleja el éxito incompleto de la mayoría de los tratamientos actuales, que mitigan y alivian, pero no curan la enfermedad.
La renovación de cardiomiocitos
A diferencia de salamandras y el pez cebra, en los que partes del corazón se pueden regenerar fácilmente después de la lesión, el miocardio de los mamíferos tiene limitada capacidad regenerativa. La pérdida de cardiomiocitos después de un infarto en seres humanos típicamente resulta en la formación de cicatrices, pérdida de la capacidad contráctil y caída de la función cardíaca. Se puede prever dos estrategias terapéuticas conceptualmente diferentes para restaurar el miocardio humano: el trasplante de células contráctiles, derivadas de células madre en cultivo o la promoción de una capacidad regenerativa endógena en el corazón. La mayoría de los esfuerzos se han dirigido hacia estrategias de trasplante celular. Dos estudios recientes describen la dinámica de la renovación de cardiomiocitos y la identificación de vías para estimular su regeneración en corazón de ratones adultos, sugiriendo que la estimulación cardíaca endógena para la reparación puede ser una opción racional y realista.
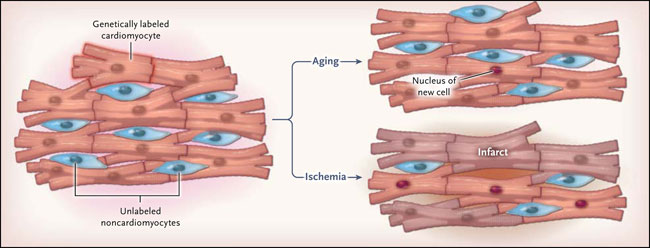
Varias investigaciones han demostrado la posible generación de cardiomiocitos en el corazón de mamíferos adultos, pero las estimaciones del alcance de este proceso han variado sustancialmente, y no está claro si estas nuevas células derivan de células madre cardíacas residentes o de células progenitoras de cardiomiocitos proliferantes. Samuel E. Senyo y colegas (Nature 2013; 493: 433-6) utilizaron una tecnología muy sofisticada para establecer la tasa de renovación y el origen de las células cardíacas en ratones adultos. Mediante la detección del isótopo 15N no-radioactivo en el ADN de células en mitosis y por medio de espectrometría de masas en secciones de tejido, se llegó a la conclusión que un 0,8% de los cardiomiocitos se sustituye cada año en ratones jóvenes y que esta tasa de reemplazo declina durante el envejecimiento. Esto se corresponde estrechamente con las estimaciones de la dinámica de rotación en el corazón humano. Al combinar el análisis de proliferación celular con el mapeo genético (método usado para determinar los derivados celulares de una célula o población de células) en ratones transgénicos, el grupo de Senyo encontró que la mayoría, si no todas, de células nuevas derivan de cardiomiocitos en división en lugar de células madre o progenitoras en el corazón adulto normal (fig. 1). También concluyeron que, en ratones, la frecuencia de proliferación de los cardiomiocitos es elevada momentos antes del infarto de miocardio. No se encontraron indicaciones de proliferación de células madre o células progenitoras que dieran lugar a nuevas unidades, aunque los autores propusieron que algunas de las nuevas células generadas después de la isquemia pudieran derivar a partir de unidades progenitoras en diferenciación dentro de los cardiomiocitos sin proliferación.
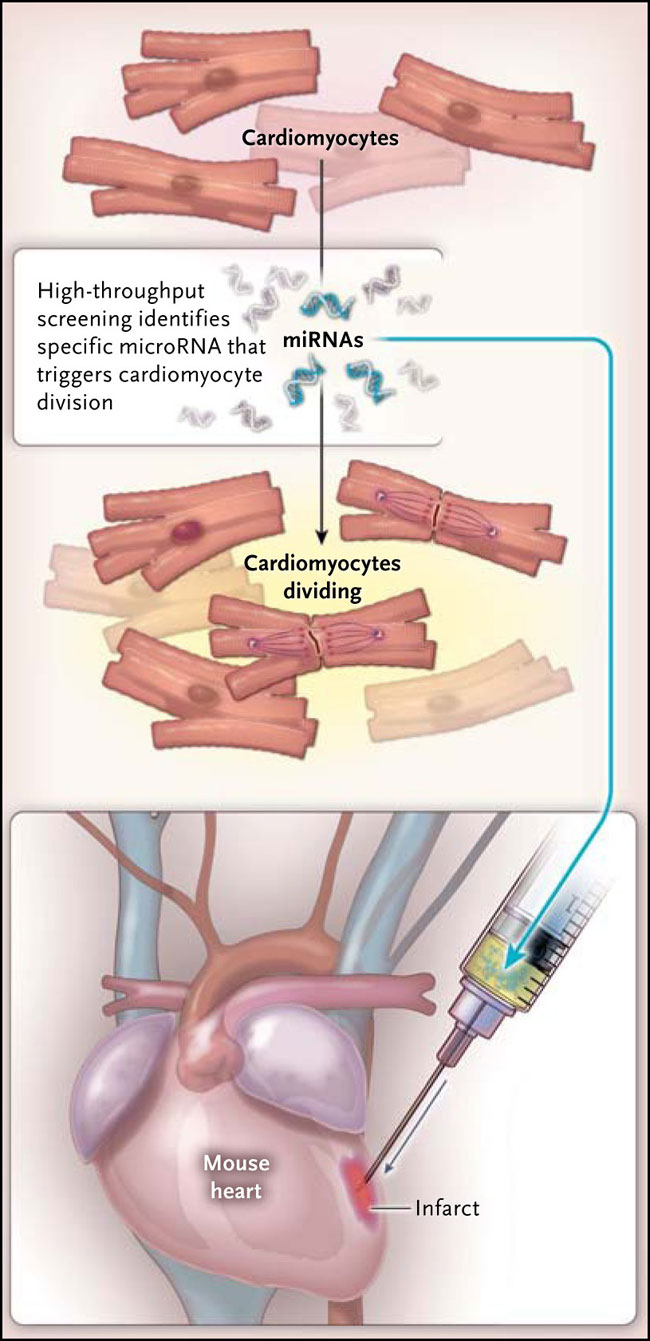
La demostración de la proliferación de cardiomiocitos plantea la cuestión sobre cómo se regula este proceso y si se puede modular para promover la regeneración cardíaca. Los microARN (miARN), moléculas cortas de ARN que bloquean la transcripción o traducción de genes específicos, tienen un fuerte efecto sobre el corazón, debido a que la ablación completa de su función interrumpe el desarrollo cardíaco y resulta en la temprana muerte postnatal. Ana Eulalio y colaboradores (Nature 2012; 492:376-81) realizaron una prueba para que tales miARN mejoraran in vitro la proliferación de los cardiomiocitos neonatales de roedores, y ellos identificaron un número sorprendentemente grande de miARN que podrían desencadenar de forma independiente la mitosis en cardiomiocitos. Varios de estos miARN aumentaban la proliferación de células cardíacas, no sólo en el cultivo celular de células adultas, sino también in vivo, cuando se inyectaban en el corazón o se expresaban por medio de vectores víricos (fig. 2). Finalmente, demostraron que la expresión forzada de dos miARN motivaba la regeneración de los cardiomiocitos y mejoraba la función cardíaca en un modelo de ratón de isquemia cardíaca.
Fuente bibliográfica
New Cells in Old Hearts
Pontus Boström, M.D., Ph.D., and Jonas Frisén, M.D., Ph.D.
Department of Cell and Molecular Biology, Karolinska Institute, Stockholm.
DOI: 10.1056/NEJMcibr1300157


