Luchando contra el VIH
Durante muchos años, se ha intentado crear una vacuna que genere inmunidad protectora contra el virus de la inmunodeficiencia humana. Como un lentivirus, el VIH se inserta en los genomas de las células huésped, típicamente en células T y macrófagos, y la infección persiste durante toda la vida, en última instancia conduce a la pérdida catastrófica de células CD4+. La clave para una vacuna eficaz contra el VIH es el desarrollo de un inmunógeno que provoque anticuerpos que persistan con una amplia actividad neutralizante frente a las diferentes cepas virales. Por desgracia, se ha avanzado muy poco en la búsqueda o el diseño de este tipo de agentes.
Vectores virales e infección por VIH
La falta de potentes vacunas contra los virus más virulentos ha impulsado la búsqueda de enfoques alternativos para la prevención y tratamiento de las infecciones. Un objetivo clave en estos esfuerzos ha sido el virus de la inmunodeficiencia humana (VIH), en el que la identificación de anticuerpos ampliamente neutralizantes (bNAb) condujo a intentos de profilaxis pasiva a través de la administración de proteínas. Si bien esta práctica parece ser segura en humanos, cuestiones de logística y cumplimiento hacen que la mantención de los niveles terapéuticos de anticuerpos sea altamente compleja.
El uso de la terapia génica de transferencia para regular la expresión génica es una táctica que permite la expresión a largo plazo de anticuerpos ampliamente neutralizantes o de otras moléculas (incluyendo antígenos, proteínas reguladoras inmunes y señales, y proteínas o ARN) que se dirigen directamente a cualquier producto del genoma viral o a proteínas de acogida necesarias para la entrada del virus o su replicación. El uso de tejidos (por ejemplo, músculo o hígado) como depósito para la expresión de un bNAb contra el patógeno no pasa por la necesidad de estimular una respuesta inmune adaptativa endógena. Por ejemplo, un vector recombinante adeno-asociado (rAAV) inyectado en el músculo esquelético de los monos expresa un bNAb contra la glucoproteína de la envoltura 120 (gp120) que protege contra la exposición repetida al virus de la inmunodeficiencia del simio (SIV). En un estudio con ratones, este enfoque también proporcionó protección contra la infección por VIH y eliminó la infección preexistente por VIH. Tales resultados favorables han dado lugar a un ensayo de fase 1 que ha involucrado a hombres sanos en relación a la seguridad einmunogenicidad de rAAV1-PG9DP contra la infección por VIH, resultados que se esperan para principios de 2016.
Sin embargo, entre el gran número de variantes aisladas de gp120, hay muchas cepas de VIH-1 que son resistentes o están sólo parcialmente neutralizadas, incluso con considerables niveles séricos de bNAb. Este problema es particularmente importante en el caso de las cuasiespecies que evolucionan en pacientes con infecciones crónicas, lo que sugiere que, se necesitan altas concentraciones de anticuerpos para su uso generalizado.
Las regiones más conservadas de la envoltura de gp120 son los epítopos que se unen al receptor primario (CD4) y a un co-receptor, por lo general CCR5 o CXCR4. La forma soluble, la inmunoadhesina del receptor CD4, CD4-Ig, puede bloquear la infección por VIH en cultivo, pero no ha tenido éxito en la clínica. Otro enfoque, en base a la secuencias de aminoácidos de algunos anticuerpos ampliamente neutralizantes, implica el uso de péptidos miméticos en dominios de correceptores que contienen sulfotirosina (dominios de CCR5 o CXCR4), los que interactúan con gp120 en la mayoría de los tipos de VIH-1, aunque con una baja afinidad en ausencia del receptor CD4. Por lo tanto, la ingeniería de una proteína que se una a gp120 y que sea capaz de bloquear su unión al receptor CD4 y a uno de sus correceptores, representaría un procedimiento atractivo.
Recientemente, Matthew R. Gardner y colaboradores (Nature 2015; 519: 87-91) lograron resultados sorprendentes mediante el uso de una proteína bifuncional optimizada que se entrega por medio de la transferencia de genes. Se utilizó una proteína de fusión que consta de CD4-Ig y un CCR5 mimético con sulfotirosina, denominada eCD4-Ig (fig. 1), la cual demostró que tenía un efecto neutralizante sobre la actividad viral mucho más fuerte en comparación a los mejores anticuerpos ampliamente neutralizantes (en una magnitud de 1 a 2 logs) cuando se evaluó por neutralización viral contra una amplia gama de VIH-1, SIV, e incluso tipos de VIH-2 en células cultivadas. Los investigadores diseñaron dos vectores de rAAV, uno que expresaba eCD4-Ig y otro la enzima tirosina sulfo- transferasa, para asegurar que eCD4-Ig estuviera sulfatado correctamente. Después de transferir el gen vector rAAV en el músculo, los investigadores sometieron a ratones humanizados y monos macacos con múltiples exposiciones a VIH y SIV, respectivamente. Los animales tratados con rAAV estaban protegidos contra la infección, en contraste con los animales control. Además, en los monos, los niveles terapéuticos de eCD4-Ig persistieron durante al menos 40 semanas. Estos hallazgos sugieren que esta proteína quimérica puede proporcionar una protección a largo plazo contra una amplia variedad de isotipos de VIH.
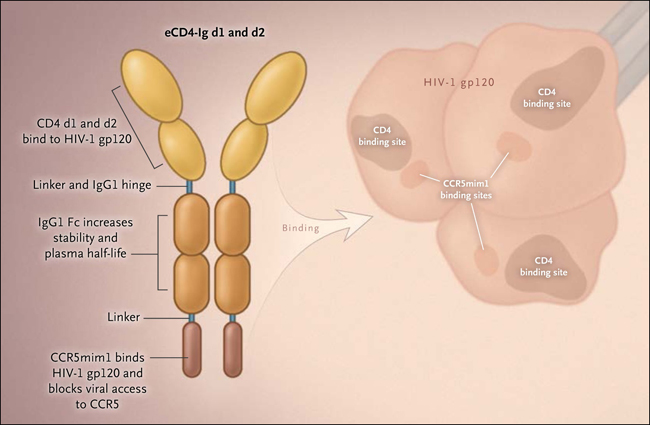
Figura 1: relaciones estructurales y funcionales en eCD4-Ig
Gardner y colaboradores reportaron recientemente una estrategia de terapia génica para combatir infecciones con VIH en animales. Esta estrategia involucra la síntesis, en músculo de la molécula eCD4-Ig, la que consiste en dos dominios (d1 y d2) en el receptor CD4 que se unen a una región altamente conservada de la envoltura de VIH-1 y otro dominio (denominado CCR5mim1) que imita al co-receptor CCR5. El dominio Fc (fragmento cristalizable) del anticuerpo IgG1 humano mejora la estabilidad y aumenta la vida media plasmática de los dominios solubles de CD4. El dominio corto CCR5mim1 es un sulfopéptido de 15 aminoácidos que carece de residuos hidrofóbicos y del enlace O- azúcar terminal del CCR5 nativo; este dominio de CCR5 se une a gp120 con alta afinidad y bloquea el acceso viral a la superficie celular. El dominio CD4 está fusionado con el dominio Fc de IgG1 humano mediante un enlazador de 4 aminoácidos (linker), mientras que la bisagra de IgG1 otorga la flexibilidad conformacional a la proteína.
La idea de utilizar vectores de transferencia genética para expresar proteínas de músculo esquelético no es nueva, pero no se han podido obtener niveles clínicamente relevantes en los seres humanos. Sin embargo, las mejoras dadas en los vectores de rAAV y las alteraciones de secuencia en el dominio del anticuerpo Fc, indican que probablemente las concentraciones terapéuticas se pueden alcanzar en los pacientes. Además, sobre la base de recientes estudios, parece que la protección antiviral se produce con niveles mucho más bajos de eCD4-Ig que con anticuerpos ampliamente neutralizantes. Una desventaja del actual enfoque es la posible exigencia de coexpresión de dos productos génicos recombinantes. En este momento, tampoco está claro cómo este tipo de enfoque podría proteger contra virus transmitidos por vía mucosa o afectar la infección del sistema nervioso central, o si será eficaz en pacientes con infección crónica. Por último, aunque eCD4-Ig es menos inmunogénico que los anticuerpos ampliamente neutralizantes, se observó una respuesta inmune de eCD4-Ig a un neoepitope creado en la proteína de fusión en los animales tratados.
En principio, el uso de la terapia génica para generar inmunidad pasiva a través de bNAbs antivirales o miméticos se puede aplicar en una amplia gama de infecciones virales. El músculo es de fácil acceso para la administración del vector, y los grupos musculares específicos que son susceptibles a la administración del vector pueden ser retirados sin consecuencia funcional. Sin embargo, no es un tejido que normalmente produzca proteínas circulantes, y que contenga células dendríticas presentadoras de antígenos que induzcan diversas respuestas inmunológicas (por ejemplo, anti-inmunoglobulina) que puedan eliminar las células transducidas o inducir autoinmunidad. El hígado, por otro lado, es un órgano que segrega muchas proteínas plasmáticas circulantes que son menos inmunogénicas, pero la desventaja es que requiere de una administración sistémica. Además, hay medios sencillos para eliminar la expresión, si fuera necesario. Sin embargo, se pueden realizar más ensayos clínicos durante la próxima década en los que se evalúen enfoques similares. Será de gran interés ver si un tipo de terapia génica o una vacuna pueda en última instancia representar el método de elección para la prevención y el tratamiento de estos tipos de infecciones virales.
Fuente bibliográfica
Viral Vectors Take On HIV Infection
Elizabeth D. Mellins, M.D., and Mark A. Kay, M.D., Ph.D.
Stanford University School of Medicine, Stanford, CA.
N Engl J Med 2015; 373:770-772


