La vacuna contra el VIH
El desarrollo de una vacuna altamente eficaz contra el SIDA probablemente dependerá del éxito en el diseño de inmunógenos que produzcan anticuerpos ampliamente neutralizantes de forma natural contra las cepas circulantes del VIH-1. Aunque los anticuerpos inducidos después de la infección con el virus1 están a menudo dirigidos a cepas específicas o determinantes no neutralizantes, es evidente que el 10% - 25% de los individuos infectados por el VIH generan respuestas de anticuerpos neutralizantes de considerable amplitud.
En el pasado, sólo los cuatro anticuerpos monoclonales de amplio espectro se pudieron identificar, pero ahora, se han aislado más de una docena. La comprensión de sus sitios de reconocimiento, la base estructural de su interacción con el VIH, y sus vías de desarrollo, generan nuevas oportunidades para diseñar vacunas que produzcan anticuerpos de amplia protección contra este virus.
Anticuerpos, VIH y neutralización
Las vacunas "universales" que produzcan anticuerpos de reacción cruzada y anticuerpos ampliamente neutralizantes (bNAb) son el objetivo final para proporcionar inmunidad protectora frente a los virus de la gripe y de la inmunodeficiencia humana (VIH). La infección con cualquiera de estos conduce a la inducción de abundantes anticuerpos específicos que son fácilmente evadidos por las variantes virales. Sin embargo, la diversidad de circulación del VIH es mayor que el de la gripe en términos de magnitud, lo que plantea un tremendo desafío para la protección mediante una vacuna.
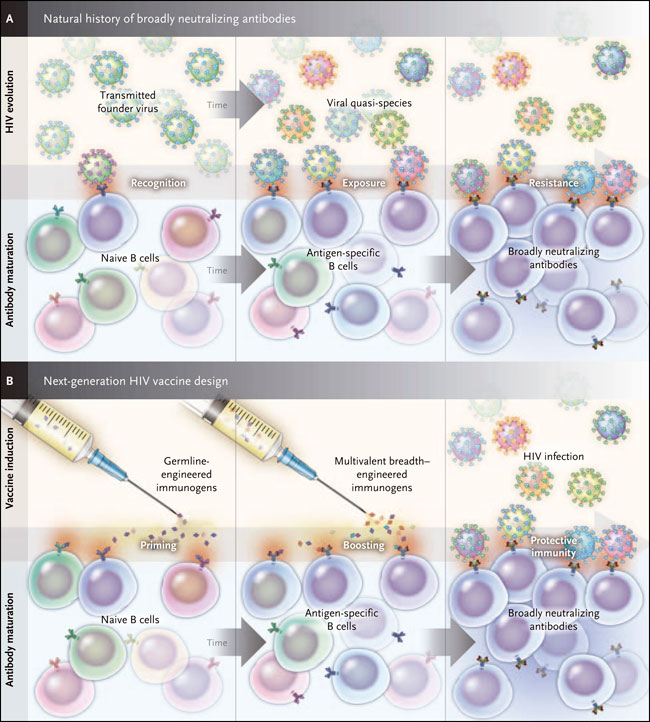
Hace algunos años, surgió la posibilidad de una vacuna contra el VIH por la evidencia que los anticuerpos ampliamente neutralizantes aparecen en 10 a 30% de las personas infectadas. Ya que estas respuestas suelen iniciarse después de 2 a 3 años del contagio, finalmente no se logra controlar la infección: la cinética de respuesta a las células B va detrás de la diversificación viral, y el proceso no puede "ponerse al día" para controlar la infección. Sin embargo, estos anticuerpos han proporcionado protección en dosis muy bajas en animales, sugiriendo que los bNAb inducidos por la vacuna podrían proporcionar inmunidad esterilizante si estuviesen presente previo a la infección. El traspaso del conocimiento de los bNAb a una vacuna sigue siendo un enorme desafío, ya que el mecanismo por el cual los anticuerpos son inducidos sigue siendo desconocido.
En comparación con otros anticuerpos, los bNAb tienen características inusuales, incluyendo estructuras físicas impares (por ejemplo, extensos bucles de unión a antígeno) y altos niveles de mutación que afectan la unión anticuerpo-antígeno y a los dominios estructurales. Estos cambios se acumulan con los años de infección y la exposición a diversas variantes virales, dando como resultado la generación de un conjunto de anticuerpos que tiene poca similitud con sus ancestros de células B (es decir, de la línea germinal).
Hua-Xin Liao y colaboradores (Nature 2013; 496: 469-76) describieron recientemente el camino por el que se desarrollan los bNAb. Ellos realizaron un seguimiento de la evolución de un único bNAb y la de un virus VIH (fig. 1), a partir de la primera semana de infección. Los hallazgos ofrecen una hoja de ruta para la inducción de anticuerpos ampliamente neutralizantes mediante la vacunación (fig. 2).
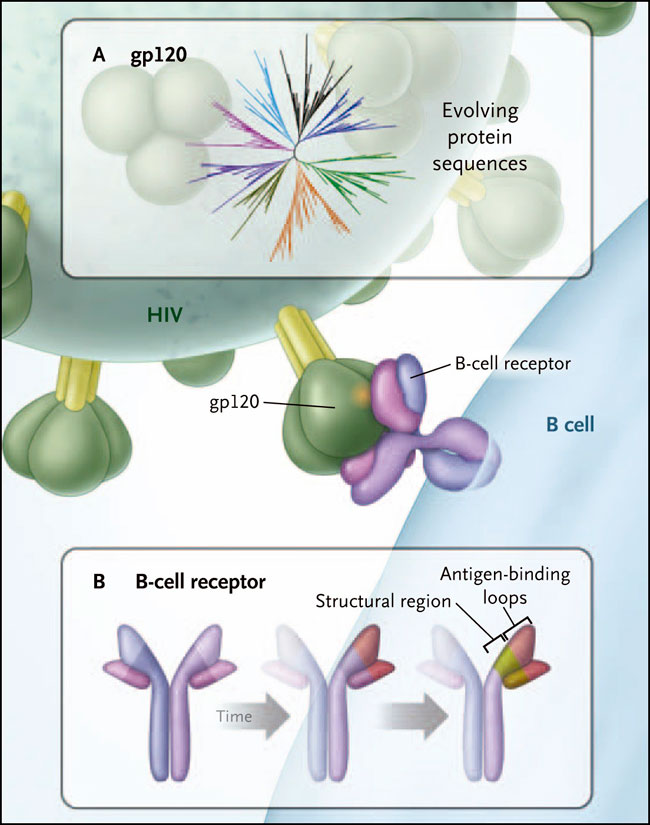
Figura 1: la co-evolución de virus y anticuerpos
Teniendo en cuenta que el receptor de células B es simplemente un anticuerpo unido a la membrana, la investigación de Hua-Xin Liao y colegas postuló que la secuenciación de receptores de células B y la diversidad viral podrían aclarar la interacción del hospedador y el patógeno, la evasión y la adaptación, dando lugar a un anticuerpo ampliamente neutralizante. Específicamente, como el virus evoluciona (panel A), también lo hace el receptor de células B (panel B), lo que resulta en mutaciones puntuales inicialmente en el dominio de unión a antígeno pero con el tiempo en el dominio estructural, tal como lo demuestra el equipo de Florian Klein, lo que mejora la actividad de neutralización de anticuerpos.
Dos acontecimientos claves diferenciaron la interacción de células B y el virus durante el desarrollo de la historia natural de los bNAb. En primer lugar, mientras en la mayoría de los escenarios la población de células B nativa no puede unirse al VIH, en personas infectadas sí se unen previamente al virus (virus de transmisión), sugiriendo que la rápida diversificación de células B se inicia al inicio de la infección. En segundo lugar, la veloz evolución de las mutaciones que afecta a los anticuerpos, requerida para una potente neutralización vía anticuerpos, se produce simultáneamente con la diversificación del virus en los primeros meses de infección. Este hecho sugiere que el momento de la exposición a las variantes virales puede ser crucial para la inducción de inmunidad por anticuerpos protectores.
A pesar que la evolución temprana de la respuesta de anticuerpos se produce predominantemente dentro del sitio de reconocimiento del antígeno, el grupo de Hua-Xin Liao encontró que los cambios evolutivos en el anticuerpo ocurren en las regiones estructurales, por cuanto estos tendrían un papel limitado en el reconocimiento de los antígenos. Sin embargo, en una publicación reciente realizada Florian Klein y colegas (Cell 2013; 153:126-38), se informa que las mutaciones que afectan a estas regiones estructurales pueden potenciar la función de los anticuerpos. Los autores encontraron que en un conjunto de bNAb, las alteraciones en las regiones estructurales no son sólo producto de una gran mutación sino que en realidad son críticas para la neutralización, proporcionando amplitud y potencia a través de múltiples mecanismos, mediante la expansión de la huella de reconocimiento del antígeno, la alteración del posicionamiento de unión del bucle y tal vez, por el cambio de la dinámica de conformación antígeno-anticuerpo.
Fuente bibliográfica
Mapping the Journey to an HIV Vaccine
Margaret Ackerman, Ph.D., and Galit Alter, Ph.D.
Thayer School of Engineering, Dartmouth College, Hanover, NH (M.A.); and the Ragon Institute of the Massachusetts General Hospital, the Massachusetts Institute of Technology, and Harvard University — all in Cambridge, MA (G.A.).
DOI: 10.1056/NEJMcibr1304437


