Esencia, crecimiento y propagación del meduloblastoma
El meduloblastoma es un tumor cerebral maligno (canceroso) que surge del cerebelo, la parte cerebral que controla el equilibrio, coordinación y otras funciones complejas. La mayoría de los pacientes tienen síntomas de dolor de cabeza y vómitos, pero también pueden padecer problemas de equilibrio y visión cuando son diagnosticados.
Alrededor de un 15 a un 20% de todos los tumores cerebrales infantiles son meduloblastoma, y se encuentran con mayor frecuencia en niños y adolescentes. Mientras que para la mayoría de los pacientes, la causa es desconocida, se han descrito algunas alteraciones genéticas que incrementan la probabilidad de desarrollar la condición.
Este cáncer es tratado más eficazmente con una combinación de terapias que incluyen cirugía, radioterapia, y quimioterapia. La extirpación quirúrgica completa del tumor es importante y suele ser el primer paso en el tratamiento. Esto generalmente seguido por uso de radiación a todo el cerebro y la columna vertebral en pacientes de mayor edad, con varios meses de quimioterapia. El manejo estándar para los niños muy pequeños (menores de 3 años de edad) incluye la remoción quirúrgica y la quimioterapia.
Interacciones tumor-estroma en el meduloblastoma
El meduloblastoma es el tumor maligno en el cerebro más frecuente en la niñez. En la actualidad, se trata con resección quirúrgica seguido de irradiación craneoespinal (en niños mayores de 3 a 4 años de edad) y quimioterapia. Los pacientes menores de 3 años con metástasis y enfermedad postoperatoria voluminosa son catalogados de "alto riesgo", al resto se les considera como "de riesgo estándar". Las tres características asociadas al elevado peligro han constituido la base de estrategias de tratamiento adaptadas al riesgo que han variado poco durante los últimos 20 a 30 años, además de la incorporación de las características histológicas seleccionadas del tumor. El objetivo de los últimos estudios ha correspondido a aumentar las tasas de curación en individuos con afección de alto riesgo y reducir las secuelas relacionadas con el tratamiento en la enfermedad de riesgo estándar. Estos ensayos han reportado tasas de curación de más del 70% de los niños afectados, pero ni las secuelas terapéuticas ni el considerable porcentaje de niños que mueren han sido totalmente eliminadas.
En contraste con los enfoques anteriores respecto a la clasificación, que consideran al meduloblastoma como una sola enfermedad, recientemente investigaciones publicadas demuestran que éste se puede dividir de acuerdo con perfiles de expresión génica en al menos cuatro grupos, cada uno con distintas características clínicas y patrones de mutaciones. Estas observaciones aplican la caracterización molecular para guiar el tratamiento estratificado y la aplicación de terapias orientadas molecularmente. Aunque tales manejos pueden ser precisos, la experiencia demuestra que los tumores son capaces de eludir a los inhibidores específicos por la adquisición de mutaciones que confieren resistencia. Un segundo reto es que la subdivisión de los meduloblastomas en varios grupos creando diferentes clases de tumor, complica el diseño de ensayos destinados a demostrar el beneficio clínico de las nuevas terapias.
En este contexto, Matija Snuderl y colaboradores (Cell 2013; 152:1065-76) se focalizaron en las interacciones tumor-estroma lo que podría bloquear el crecimiento neoplásico de los múltiples subtipos de meduloblastoma, para así contrarrestar las vías que promueven la supervivencia del meduloblastoma. Sobre la base de estudios que informaban la marcada sobreexpresión del factor de crecimiento placentario (PlGF) y uno de de sus receptores, la neuropilina 1 (NRP1), en múltiples subtipos de meduloblastoma, los autores postularon que PlGF representaría un objetivo destacable en los diferentes tumores. Probaron tal hipótesis en modelos de ratón, utilizando líneas celulares humanas de meduloblastoma, y en un modelo transgénico. Encontraron que los anticuerpos contra el PlGF murino y humano podían retrasar el crecimiento tumoral, prolongar la supervivencia e inhibir la metástasis vertebral. El silenciamiento genético de PlGF humano en xenoinjertos tuvo efectos similares. El PIGF derivado de tumor era sólo un componente del proceso, ya que el cáncer podría inducir la producción de PIGF por el estroma (el meduloblastoma que producía PIGF era de origen humano, mientras que las células del estroma que secretaban Plgf eran de origen murino). La contribución del PIGF estromal se observó mediante el uso de un anticuerpo específico para la proteína de ratón, Plgf, que inhibe el crecimiento del tumor y su propagación, un hallazgo que sugiere que aunque los meduloblastomas produzcan PIGF, el Plgf estromal es el determinante más importante del crecimiento del tumor (figura 1).
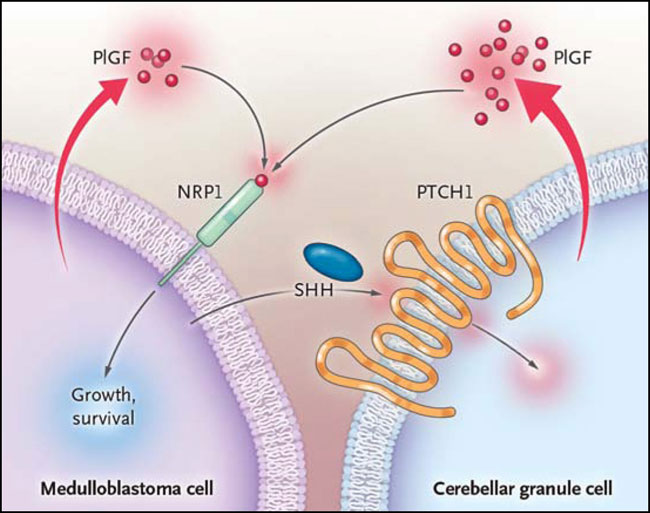
Figura 1: influencia del factor de crecimiento placentario estromal y tumoral en la señalización mediada por NRP1
Esta representación esquemática del modelo basado en observaciones por el equipo de Matija Snuderl pone de relieve las posibles contribuciones del factor de crecimiento placentario producido por el tumor y el estroma humano (PlGF) en la señalización de la neuropilina 1 (NRP1), pero también muestra el crecimiento resultante de los meduloblastomas y la promoción de la supervivencia de las células malignas. Las unidades de los meduloblastomas producen PlGF para estimular a NRP1 de forma autocrina (a la izquierda), y también estimulan esta vía en un grado aún mayor al influir en la producción de PlGF paracrina (a la derecha). El modelo propuesto por estos autores sugiere que esta vía paracrina está mediada a través de los efectos sobre el homólogo "patched" 1 (PTCH1), impulsada por la secreción de Sonic hedgehog (SHH) vía meduloblastoma. La interacción de SHH-PTCH1 activa una cascada de señalización dentro de las células del estroma que lo rodean, componentes que sólo están parcialmente definidos (área de color rosa en la célula cerebral). La cascada de señalización promueve la liberación del PlGF estromal y la resultante estimulación de NRP1 paracrina.
También fue examinado el mecanismo de accionamiento del Plgf estromal. Se observó que la expresión de la molécula de señalización Sonic hedgehog (Shh) era un potencial contribuyente. Por otra parte, la administración de un inhibidor de Shh disminuyó los niveles de Plgf en ratones portadores de meduloblastoma. En situaciones en las que la producción de Plgf estromal estaba disminuida, la generación de Plgf tumoral se incrementaba, sugiriendo que el tumor puede compensar la disminución de Plgf estromal por medio de la mayor producción intrínseca. Sobre la base que la exposición de las células a los efectos de Plgf en la activación de las proteínas quinasas activadas por mitógenos (Mapk) y la proteína cinasa Akt, los autores concluyeron que Plgf estimulaba el crecimiento y reprimía la apoptosis; la inhibición de Mapk disminuyó la viabilidad de los meduloblastomas.
Por último, para evaluar las vías del receptor subyacente a los efectos de PlGF, los investigadores examinaron las aportaciones del factor de crecimiento endotelial vascular (VEGFR1) y de NRP1. Considerando que la caída de NRP1 inhibe el crecimiento tumoral y las metástasis vertebrales, no se observaron los mismos efectos con la menor regulación de VEGFR1. Los anticuerpos contra NRP1 inhibieron el crecimiento tumoral y mejoraron la supervivencia, por el contrario, la sobreexpresión de NRP1 en muestras clínicas se asoció con una supervivencia global.
Estos resultados plantean varias interrogantes. En primer lugar, ¿cómo estas observaciones se pueden explotar terapéuticamente? Los autores promueven la utilización de anticuerpos contra NRP1 o PIGF, los que se están evaluando en ensayos clínicos para el tratamiento de otros tumores. Sin embargo, el uso de anticuerpos contra tumores cerebrales se ve complicado por las barreras sangre-cerebro y sangre-líquido cefalorraquídeo (LCR), a pesar que la primera suele estar comprometida en pacientes con meduloblastomas, la segunda se puede eludir por medio de la entrega intratecal. Si se desarrollasen pequeñas moléculas inhibidoras, estaríamos ante un enfoque alternativo. En segundo lugar, ¿se puede anticipar el grado del efecto clínico? Estudios preclínicos han demostrado que el bloqueo de PIGF da lugar a un retraso en el crecimiento tumoral y menos metástasis, pero no la eliminación del cáncer, lo que plantea preocupaciones acerca de la actividad clínica que puede observarse con terapias dirigidas al estroma. Al igual que muchas estrategias de tratamiento, se espera que los enfoques multiagentes traten con eficacia el meduloblastoma, y la priorización de la inhibición de PlGF como un futuro régimen de tratamiento probablemente esté influenciado por las características genéticas del meduloblastoma, favoreciendo enfoques genómicos alternativos. Por último, dada la predisposición de los tumores sólidos para adquirir resistencia, ¿puede la focalización sobre el estroma, en lugar de las células tumorales, evitar este proceso? Se necesitan estudios adicionales para abordar esta cuestión y la eficacia relativa de los tratamientos en tumores específicos, en comparación con terapias dirigidas al estroma.
Fuente bibliográfica
Tumor–Stromal Interactions in Medulloblastoma
Ian F. Pollack, M.D.
Department of Neurosurgery, Children’s Hospital of Pittsburgh of UPMC, University of Pittsburgh School of Medicine, Pittsburgh.
N Engl J Med 2013; 368:1942-194


