El lado oscuro de la inhibición tumoral
Los linfomas no Hodgkin de células T son un grupo heterogéneo de tumores malignos altamente agresivos con pobres resultados clínicos. Se originan a partir de células T periféricas y se caracterizan frecuentemente por variantes genéticas de ganancia de función en las moléculas de señalización del receptor de células T (TCR). Aunque se cree que estas alteraciones oncogénicas impulsan las vías de señalización de TCR para inducir la proliferación crónica y programas de supervivencia celular, no está claro si las células T contienen supresores tumorales que puedan contrarrestar estos eventos. Recientes estudios han identificado a PD-1, como una proteína receptora de membrana que al ser inhibida suprime la proliferación de células T oncogénicas. Sin embargo, al bloquear la proteína PD-1 en linfocitos T tumorales, éstas pueden activarse y proliferar, evento que exacerba un cáncer que afecta a las células T, como el linfoma no Hodgkin.
Inhibición de PD-1
La terapia del cáncer ha sido revolucionada por medicamentos que mejoran la activación de linfocitos T, que pueden reconocer y eliminar directamente las células dañadas o cancerosas en el cuerpo. La administración de dichos medicamentos provoca que el propio sistema inmunitario combata los tumores. Pero, ¿qué sucede si las células cancerosas son las células T? Wartewig y sus colegas recientemente dieron a conocer que una inmunoterapia contra el cáncer ampliamente utilizada es capaz de promover activamente la progresión tumoral en un modelo murino de un cáncer llamado linfoma no Hodgkin de células T (T-NHL) (doi: 10.1038/nature24649. Epub 2017 Nov 15).
La hiperactivación de las células T durante exposiciones crónicas a patógenos puede dañar los tejidos sanos circundantes. Para proteger al cuerpo de este fenómeno, las células T expresan un receptor de membrana llamado proteína de muerte celular programada-1 (PD-1). Cuando PD-1 está unido a su ligando, se activa la señalización de PD-1. Esto inhibe la señalización del receptor de células T (TCR), atenuando la señalización río abajo a través de las vías PI3K y PKCθ2 y haciendo que las células T sean inactivas y no proliferativas. Pero este mecanismo de protección también puede ser utilizado por células tumorales, que a menudo expresan ligandos de PD-1 en sus superficies que les permiten prevenir respuestas de células T y escapar de la destrucción. La reactivación de las células T para actuar contra los tumores usando un anticuerpo que bloquea la unión del ligando a PD-1 se ha convertido en una parte integral de la terapia para varios cáncer (figura 1a).
Durante una investigación de los mecanismos subyacentes al T-NHL, Wartewig y sus colegas descubrieron una función previamente desconocida para PD-1 en cánceres de células T. Los autores hicieron uso de un modelo de ratón de T-NHL en el que un subconjunto de este tipo celular fue diseñado para expresar una proteína cancerosa que impulsa el T-NHL humano. Estos linfocitos proliferan continuamente, lo que lleva al cáncer. Mediante el uso de un enfoque genético para introducir mutaciones aleatorias en las células T de los animales, los investigadores encontraron que al interferir con la expresión de PD-1 se inducía la proliferación masiva de células T cancerosas. Además, en humanos, las mutaciones en el gen que codifica PD-1 se correlacionan con un linfoma más agresivo.
Esto tiene sentido, porque en el T-NHL, las células T son las células tumorales. La inactivación de células T por medio de la señalización de PD-1 no protege del tumor, como sería normalmente el caso, sino que permite la proliferación de células cancerosas (figura 1b). Por lo tanto, los tumores de células T tales como T-NHL pueden beneficiarse de la pérdida de señalización de PD-1. La fuente del ligando PD-1 que activa la señalización de PD-1 en el T-NHL podría ser amplio rango de tipos de células inmunes, o incluso las propias células tumorales.
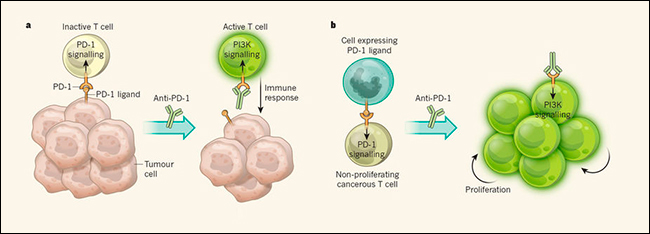
Figura 1. Rol dual para la proteína receptora PD-1
a, PD-1 se expresa en la superficie de las células T. Cuando PD-1 está unida por un ligando producido por las células tumorales, la señalización de PD-1 vuelve a las células T inactivas, previniendo respuestas inmunes que destruirían el tumor. El tratamiento con un anticuerpo contra PD-1 bloquea la unión del ligando y, por lo tanto, la señalización de PD-1, y se promueve la ruta de señalización de PI3K, que está implicada en la activación de las células T. Como tal, el tratamiento anti-PD-1 desencadena una respuesta inmune. b, Wartewig y sus colegas han demostrado que la señalización de PD-1 en un modelo de ratón de linfoma no Hodgkin de células T impide la proliferación de células T cancerosas (no se definió la fuente del ligando PD-1). En estos ratones, el tratamiento con anti-PD-1 puede agravar la enfermedad al reactivar la continua proliferación de las células T cancerosas.
Finalmente, los autores mostraron que el tratamiento de estos animales modelo de T-NHL con un anticuerpo anti PD-1, como se haría para los pacientes, condujo a la proliferación rápida y letal de células T cancerosas. Esto pone de relieve un posible efecto secundario del uso el tratamiento anti-PD-1 en la clínica. El tratamiento anti-PD-1 mejora significativamente las tasas de supervivencia asociadas con las terapias para varios tipos de tumores sólidos, incluidos los cáncer de piel y pulmón. También ha demostrado ser beneficioso en cánceres de sangre que no derivan de células T. Pero el trabajo de Wartewig y sus colegas indica que el tratamiento en realidad podría empeorar ciertos cánceres. Los autores sugieren que, en humanos que tienen mutaciones de PD-1, el uso de inhibidores de PI3K podría ser preferible al tratamiento con un anticuerpo anti-PD-1.
¿Cómo deben interpretarse estos hallazgos en el contexto del cáncer humano? Primero, es necesario considerar que la población de células T es diversa y contiene varios subconjuntos que tienen funciones y características distintas. Un estudio mostró recientemente que el bloqueo de PD-1 activa subconjuntos específicos de células T, en lugar de tener un efecto general en toda la población. Esto sugiere que el tratamiento anti-PD-1 podría agravar la progresión de la enfermedad solo si induce la proliferación del subtipo específico de células T que produjo el cáncer (doi: 10.1016/j.cell.2017.07.024).
En segundo lugar, la inhibición de PD-1 también afecta a otros tipos de células en el microambiente tumoral, por ejemplo, las células inmunitarias conocidas como macrófagos que "tragan" las células dañadas y las eliminan a través de un proceso llamado fagocitosis. En un entorno tumoral, los macrófagos no eliminan necesariamente las células tumorales; en su lugar, pueden promover su crecimiento. PD-1 se expresa en macrófagos asociados a tumores, y su señalización reduce la fagocitosis. Además, el tratamiento anti-PD-1 restaura la fagocitosis en macrófagos relacionados con tumores y reduce la carga tumoral. Estos datos indican que los macrófagos deben considerarse al analizar los efectos del bloqueo de PD-1 sobre el cáncer.
El bloqueo PD-1 se ha utilizado previamente en pacientes con linfoma de células T sin producir resultados tan nefastos, pero se necesitan descubrir otros mecanismos en juego. Tal vez el bloqueo PD-1 activa otros tipos de células que combaten el tumor, o tal vez no afectan el subtipo de células T cancerosas de estos pacientes.
En la era de las inmunoterapias contra el cáncer, el estudio de Wartewig y sus colegas plantea un punto importante: los fármacos que estimulan la actividad de las células T deben estudiarse cuidadosamente para garantizar que su uso no desencadene la proliferación de células cancerosas. Aún se necesita una mejor comprensión de los mecanismos que subyacen a los efectos del bloqueo de PD-1 en tumores derivados de células T. Entender qué células se ven específicamente afectadas por el bloqueo de PD-1 y qué características anormales adquieren después del tratamiento permitiría una evaluación de la eficacia del tratamiento anti-PD-1 para tratar tipos específicos de T-NHL. Este conocimiento debería mejorar los tratamientos ofrecidos en la clínica y reducir los posibles efectos secundarios.
Fuente bibliográfica
Cancer immunotherapy: The dark side of PD-1 receptor inhibition.
Aya Ludin & Leonard I. Zon
Department of Stem Cell and Regenerative Biology, Harvard Stem Cell Institute, Harvard University, Cambridge, Massachusetts 02138, USA.
doi:10.1038/nature24759


