¿El colesterol modifica la respuesta inmune?
El colesterol puede iniciar o inhibir reacciones inflamatorias en función de su ubicación y estado físico. Es el encargado de formar las bicapas lipídicas de la membrana celular, junto con los fosfolípidos y esfingolípidos, regular la fluidez de la membrana y muchas de sus funciones, tal como la endocitosis. También modula la transducción de señales de una serie de receptores.
Los niveles altos de colesterol en sangre constituyen el factor de riesgo más importante para la enfermedad arterial coronaria aterosclerótica. Se ha demostrado que en sí mismo puede causar inflamación en su forma cristalina mediante la activación del inflamasoma NLRP3. Por lo tanto, es posible que la transición de su fase soluble a cristalina sea detectada por las células inmunes, lo que proporcionaría una explicación molecular bastante simple para los efectos pro-inflamatorios debido a sus excesivos niveles en sangre y tejidos.
Metabolismo del colesterol y la inmunidad
La investigación clínica ha proporcionado evidencia creciente para la diafonía entre el metabolismo del colesterol y el sistema inmune, proporcionando una mayor comprensión de la respuesta del huésped a la infección y de los componentes inflamatorios de la enfermedad cardiovascular, tales como la aterosclerosis. Un ejemplo reciente es la investigación realizada por Andrea Reboldi y colaboradores (Science 2014; 345:679-84) que han podido concluir que el 25-hidroxicolesterol regula estrechamente la interleucina-1β, una potente citoquina.
El metabolito 25-hidroxicolesterol es un oxysterol que deriva del colesterol (fig. 1A). A pesar que influye en la homeostasis del colesterol por medio de la supresión de la proteína de unión al elemento de respuesta a los esteroles (SREBP), su efecto principal parece estar en la regulación inmune. La enzima más potente que transforma el colesterol en 25-hidroxicolesterol es la colesterol 25-hidroxilasa (CH25H), generada principalmente en monocitos, macrófagos y células dendríticas, el principal tipo de células del sistema inmune innato que sintetiza la interleucina-1β (CH25H no se expresa en el hígado, el órgano más activo en la síntesis de ácidos grasos y colesterol). Los ratones que carecen Ch25h tienen una homeostasis de colesterol normal (pero también sintetizan pequeñas cantidades de 25-hidroxicolesterol), aunque padecen importantes cambios en su respuesta inflamatoria.
La expresión de CH25H está fuertemente inducida por lipopolisacáridos, interferones tipo I que son importantes citoquinas antivirales, uno de los cuales (interferón-β) se utiliza para tratar la esclerosis múltiple, y por la infección viral, lo que lleva a un aumento de las concentraciones de 25-hydroxycholesterol. El equipo de Reboldi encontró que el 25-hidroxicolesterol media la inhibición de interleucina-1β inducida por el interferón tipo I. Más específicamente, el 25-hidroxicolesterol inhibe la transcripción génica de la pro-interleuquina-1β, así como la activación mediada por el inflamasoma de interleucina-1β (fig. 1B) mediante la inhibición de la activación de SREBP. Ellos encontraron que los macrófagos de los ratones knock-out para Ch25h producen más interleucina-1β cuando se exponen a un lipopolisacárido y que esto se puede corregir mediante la adición de 25-hidroxicolesterol al medio de cultivo. Estos animales eran más susceptibles que los ratones tipo salvaje a la letalidad inducida por el lipopolisacárido debido al aumento de producción de citoquinas.
Una enfermedad hereditaria rara que une el metabolismo del colesterol y la inflamación es la deficiencia de la mevalonato quinasa, que es una enzima temprana en la vía del colesterol (fig. 1A), y las mutaciones en su gen causan una reducción sustancial de la actividad enzimática. Los pacientes con deficiencia de mevalonato quinasa tienen episodios recurrentes de inflamación generalizada con fiebre, mediada por citocinas tales como la interleucina-1β. Muchos de estos individuos tienen aumentadas las concentraciones séricas de IgA e IgD, elevaciones también observadas en los ratones deficientes en mevalonato quinasa. La hipótesis actual es que la isoprenilación defectuosa de la proteína (con menor activación de la guanosina trifosfatasa [GTPasas]) representa la relación entre una deficiencia de la mevalonato quinasa y la presencia de inflamación (fig. 1A). Pero una deficiencia en 25-hidroxicolesterol es también una relación hipotética, ya que el 25-hidroxicolesterol igualmente afecta a las células B. Los ratones knock-out Ch25h también poseen altos niveles séricos de IgA. Además, es bien sabido que la infección viral (y la vacunación) puede provocar una reacción inflamatoria en personas con deficiencia de mevalonato quinasa.
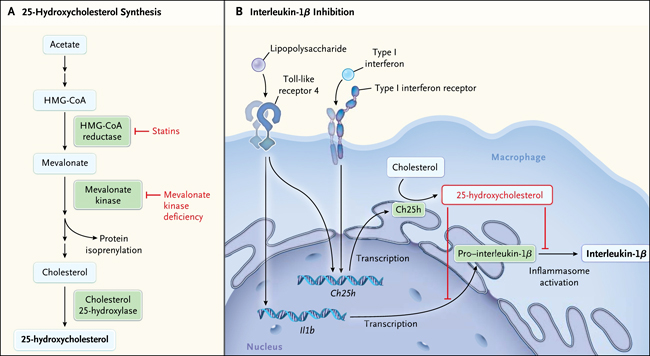
Figura 1: derivación de 25-hidroxicolesterol y la inhibición de la interleucina-1β por 25-hidroxicolesterol.
El panel A muestra una representación simplificada de la vía de colesterol, con tres enzimas activadoras indicadas en verde. Las estatinas son inhibidores de la 3-hidroxi-3-metilglutaril coenzima A (HMG-CoA) reductasa. El defecto genético en la deficiencia de mevalonato quinasa se encuentra en ella misma. El panel B muestra que la producción de 25-hidroxicolesterol es inducida por interferones tipo I, liberados durante la infección viral, y también por los lipopolisacáridos. El metabolito 25-hidroxicolesterol reduce la producción de interleucina-1β por la inhibición de la transcripción de la pro-interleuquina-1β y por la inhibición de la activación de pro-interleuquina-1β por inflamasomas. Ch25h denota el colesterol 25-hidroxilasa, y IL1B el gen que codifica la interleucina-1β.
A pesar que una rápida respuesta inflamatoria es importante en la lucha contra los patógenos, otra excesivamente robusta puede dañar al anfitrión y causar complicaciones. Por lo tanto es importante que la inflamación como la infección esté bajo control. La inhibición de la interleucina-1β por el 25-hidroxicolesterol puede representar un mecanismo de contención. Varios estudios han demostrado otras funciones inhibidoras del 25-hidroxicolesterol en modelos celulares de infección viral, tales como la inhibición de la entrada viral en la célula, y la inhibición de la replicación viral. Por otro lado, Elizabeth S. Gold y colegas (Proc Natl Acad Sci U S A 2014; 111:10666-71), al utilizar un enfoque de biología de sistemas, encontraron que el 25-hidroxicolesterol amplificaba la inflamación. Ellos determinaron que los ratones knock-out Ch25h tenían más probabilidades que los tipo salvaje para sobrevivir a una gripe, debido a un menor daño inflamatorio. Se requieren estudios adicionales para resolver este enigma.
Se ha sugerido que las estatinas, que son 3 hidroxi- 3 metilglutaril coenzima A (HMG-CoA) reductasa (fig. 1A), podrían conferir un beneficio de supervivencia en la gripe, aunque la evidencia al respecto todavía es escasa. También se le han atribuido diversos efectos antiinflamatorios, así como algunos proinflamatorios. Hasta ahora, sin embargo, los efectos de las estatinas o la hipercolesterolemia en la producción de macrófagos de 25-hidroxicolesterol no están claros.
A pesar que las preguntas siguen sin respuesta, el estudio realizado por el grupo de Andrea Reboldi concede información importante del papel del 25-hidroxicolesterol en la inmunidad y, más específicamente, en la respuesta del huésped contra la infección viral. Con múltiples amenazas virales para las poblaciones a nivel mundial, nuevos conocimientos sobre la respuesta del huésped a la infección viral – que pueden proporcionar diversos abordajes para nuevos enfoques clínicos - son muy bienvenidos.
Fuente bibliográfica
Cholesterol Metabolism and Immunity
Anna Simon, M.D., Ph.D.
Department of Internal Medicine, Radboud University Medical Center, Nijmegen, the Netherlands.
DOI: 10.1056/NEJMcibr1412016


