Cáncer colorrectal, por culpa de la inflamación
La conexión entre la inflamación y la tumorigénesis está bien establecida y en la última década ha recibido una gran cantidad de evidencia de apoyo a partir de datos genéticos, farmacológicos y epidemiológicos. Por ejemplo, la enfermedad inflamatoria intestinal es un factor de riesgo importante para el desarrollo del cáncer de colon. Probablemente, la inflamación participa con otras formas esporádicas de cáncer, así como en el cáncer de colon hereditario.
Los mecanismos moleculares por los cuales la alteración patológica promueve el desarrollo oncológico todavía se tienen que dilucidar y pueden diferir entre las formas asociadas a la colitis y otros tipos de cáncer colorrectal. Los actuales trabajos de investigación han evidenciado el papel de las diferentes células inmunes, citocinas y otros mediadores inmunes en prácticamente todas las etapas de la tumorigénesis de colon, incluyendo la iniciación, promoción, progresión y metástasis.
Barreras epiteliales, microbiota y cáncer colorrectal
El cáncer colorrectal es una enfermedad que provoca anualmente unas 600.000 muertes cada año. La evolución de los pólipos de colon de adenomas displásicos a adenocarcinomas se define histológicamente, en parte, por la invasión del tejido de la submucosa a través de la mucosa muscular. Esta avance es el reflejo de muchas mutaciones a lo largo de una vía genética que involucra la pérdida inicial del gen supresor de tumores para la poliposis adenomatosa coli (APC) y la activación de mutaciones en genes como KRAS, PIK3CA y TP53. Una síntesis de los diversos aspectos de la patogénesis del cáncer colorrectal - mutaciones genéticas epiteliales, integridad de la mucosa, microbiota y el papel de la inflamación - se recoge de un reciente estudio realizado por Sergei I. Grivennikov y colegas (Nature 2012; 491:254-8).
La incidencia del cáncer colorrectal es mucho mayor en países desarrollados que en los subdesarrollados, lo que reflejaría la influencia de factores ambientales, como la dieta y estilo de vida. El famoso cirujano irlandés Denis Burkitt, que pasó muchos años en Uganda, ilustró los efectos del bajo y alto consumo de fibras mediante un enfoque un tanto inusual al comparar directamente la calidad y cantidad de las heces. Fue uno de los primeros médicos que se permitió sugerir que la dieta contribuía a la menor incidencia de cáncer colorrectal en África. En la actualidad existe una considerable evidencia observacional que apunta a que las dietas occidentales escasas en fibras pero ricas en carnes rojas, grasas saturadas y azúcares procesados, están asociadas con el cáncer colorrectal, además de la obesidad, la enfermedad cardiovascular y diabetes mellitus tipo 2. También hay bastante información que señala que la aspirina y otros fármacos antiinflamatorios no esteroideos pueden ayudar prevenir el crecimiento de pólipos y de cáncer en el colon, hallazgos que sugieren un rol de la inflamación en la patogénesis de la enfermedad. De hecho, el cáncer colorrectal es más común en personas con enfermedad inflamatoria intestinal que en aquellas no afectadas.
Se sabe que la microbiota intestinal influencia la salud del huésped, y la ciencia del mutualismo huésped-microbio es un campo en rápida expansión. Las enfermedades luminales y sistémicas (por ejemplo, la diabetes mellitus) pueden verse influenciadas por la microbiota. Parece muy plausible pensar que nuestra dieta influye sobre el cáncer colorrectal a través de cambios en la microbiota.
El presente estudio analizó el efecto de la microbiota en la inflamación del intestino. Aunque los investigadores se basaron principalmente en un modelo de ratón para el cáncer colorrectal que implicaba un knockout de APC, los resultados se podrían extrapolar, cuando sea posible, al análisis de muestras humanas. Otra investigación reciente indicó que un firma molecular "inflamatoria" en el cáncer colorrectal humano, respuesta a células T helper tipo 17 (Th17) (es decir, aquella que produce la interleucina-17) predominaba sobre la respuesta a células T helper tipo 1 (Th1) (es decir, uno que produce el interferón-γ y es citotóxica), está asociada con un peor pronóstico, incluso para la enfermedad en estadio temprano. Sergei I. Grivennikov y colegas encontraron que los cánceres colorrectales en humanos y de ratón secretan mayores cantidades de interleucina-23 e interleucina 17. La primera es producida por las células mieloides en la mucosa a través de la estimulación de los receptores tipo toll (TLR) por productos bacterianos derivados de la microbiota comensal. La interleucina-23 actúa entonces sobre las células, incluyendo en los linfocitos, lo que contribuye a la firma inflamatoria que comprende a la interleucina-17, interleucina-6 y a la interleucina-22. Aunque los investigadores se centraron en la interleucina-17, es importante recordar que otras citoquinas con niveles aumentados, como la interleucina-22, también pueden tener un papel clave en la tumorigénesis. Cuando se trataron los ratones con antibióticos de amplio espectro o se utilizaron modelos deficientes en interleucina-23 o de su receptor o de MyD88 (una proteína adaptadora que media la señalización de TLR), se encontró un menor desarrollo de neoplasias colorrectales.
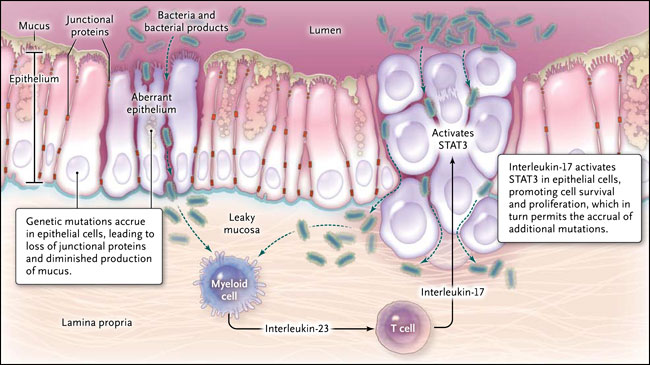
Los investigadores también pudieron demostrar que la transformación de células epiteliales con mutaciones genéticas conducían a la pérdida de la función APC y a la activación de β-catenina, así como al desarrollo de adenomas de colon y carcinomas, todos procesos relacionados con la pérdida funcional de barrera del epitelio (es decir, el aumento de "filtración"), evidenciado en los menores niveles de mucinas superficiales y de proteínas de unión intercelular. Estos cambios en las células epiteliales luminales permiten que las bacterias se trasladen más fácilmente en la lámina propia y activen las células mieloides, que conducen a la producción de interleucina-23; esto impulsa la interleucina-17 y promueve aún más la proliferación de células epiteliales, resultando en la pérdida gradual de la función y la tumorigénesis (fig. 1).
Fuente bibliográfica
Epithelial Barriers, Microbiota, and Colorectal Cancer
Awen M. Gallimore, D.Phil., and Andrew Godkin, M.D.
School of Medicine, Cardiff University (A.M.G., A.G.), and the University Hospital of Wales (A.G.) — both in Cardiff, Wales, United Kingdom.
DOI: 10.1056/NEJMcibr1212341


