Cáncer por culpa del virus de Epstein-Barr
Con raras excepciones, todos los seres humanos llevan el virus de Epstein-Barr. Si bien se ha podido demostrar que este virus induce la proliferación de linfocitos B, también se sabe que es en gran parte inofensivo. La coexistencia armoniosa huésped-virus es el resultado de una larga historia con adaptación mutua, sobre la base de la variación en la expresión del gen viral en diferentes tipos de células infectadas y la respuesta inmune final de las personas. Esto es posible porque el sistema inmunitario reconoce las células que expresan las proteínas que promueven el crecimiento anómalo, por lo tanto, dichas unidades se eliminan de forma natural.
El Epstein-Barr puede contribuir, sin embargo, a otros tipos de tumores malignos que surgen en diferentes tipos de células. Estas células portadoras del virus no son estimuladas a la proliferación por el virus, pero su fenotipo ha cambiado. Adquieren alteraciones que modifican las interacciones celulares, y la producción y respuesta a las citosinas, las que suelen evitar la apoptosis y tener una mejor respuesta a las señales que estimulan el crecimiento.
Cáncer y el virus de Epstein-Barr
El virus de Epstein-Barr (VEB) se asocia a una variedad de cánceres linfoides, incluyendo el linfoma de Burkitt y el linfoma de Hodgkin. En algunos pacientes que reciben tratamiento inmunosupresor después del trasplante de órganos sólidos o de células hematopoyéticas, el VEB también se relaciona con la enfermedad linfoproliferativa postrasplante. Esta devastadora complicación por lo general sigue al trasplante de un órgano infectado a un destinatario sano. El virus inserta su genoma en las células B, donde se traducen en proteínas virales y, finalmente, transforma las células B a través de la acción de oncoproteínas virales. El VEB evade el sistema inmune del huésped mediante la supresión de células T citotóxicas CD8 específicas para el virus, controlando por lo tanto la proliferación de células B.
Las opciones de tratamiento para la enfermedad linfoproliferativa postrasplante son limitadas y no completamente eficaces, implicando considerables efectos tóxicos. Los actuales esquemas terapéuticos incluyen la reducción de la inmunosupresión (con el consiguiente riesgo de rechazo del trasplante); tratamiento con agentes antivirales (una opción controvertida, debido a que se cree que la infección por VEB que es principalmente latente); el uso del anticuerpo monoclonal rituximab, que disminuye las células B transformadas que expresan el receptor CD20, o la quimioterapia (fig. 1).
Los estudios in vitro han demostrado que el pamidronato, un bisfosfonato que reduce el recambio óseo y se utiliza en el tratamiento de la osteoporosis, tiene propiedades inmunológicas adicionales. Específicamente, induce la acumulación intracelular de pirofosfato de isopentenilo, el que a su vez activa y expande una clase de células T γδ llamadas células T Vγ9Vδ2; estas tienen características de célula asesina natural y son parte del sistema inmune innato. Las células T Vγ9Vδ2, a través de la expresión de un receptor específico de la superficie celular, son capaces de desencadenar de manera eficiente la muerte celular que conduce a la lisis de la línea celular linfoblastoide B humana autóloga trasformada por VEB.
Zheng Xiang y colaboradores (Cancer Cell 2014; 26:565-76) han informado recientemente de estos resultados aplicados en un modelo de ratón para la enfermedad linfoproliferativa por VEB. Utilizaron ratones modificados genéticamente sin células inmunes funcionales. La transferencia de una línea celular linfoblastoide B humana autóloga trasformada con VEB por vía subcutánea humana a estos animales creó un modelo de enfermedad linfoproliferativa de células B, con muchas características sintomáticas similares a las de la condición humana. En este modelo de enfermedad linfoproliferativa por VEB, la transferencia de células T Vγ9Vδ2 humanas con pamidronato previno el desarrollo de la enfermedad. Además, en ratones con enfermedad linfoproliferativa VEB establecida, la transferencia intravenosa de células T Vγ9Vδ2 humanas con pamidronato llevó a la necrosis, calcificación, fibrosis de los tumores, crecimiento tumoral restringido y la supervivencia prolongada.
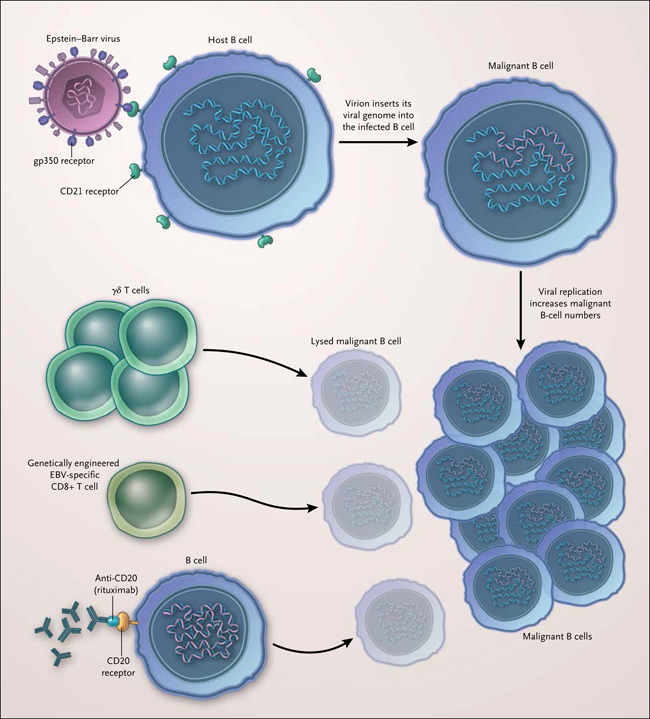
Figura 1: ciclo del cáncer inducido por EBV y enfoques terapéuticos
El virus de Epstein-Barr infecta a la célula B huésped a través de una interacción entre su propio receptor gp350 y el receptor de superficie de células B CD21. A continuación, el virión inserta su genoma en el genoma de las células B, lo que conduce a la replicación viral y la transformación de células B malignas. El sistema inmune del huésped responde con células T γδ, que lisan las unidades infectadas.
Este modelo, sin embargo, no permitió la evaluación de cómo el sistema inmune humano responde a las líneas de células linfoblastoides B transformadas por VEB. El equipo de Xiang, por lo tanto, desarrolló una línea de ratones en el que un sistema inmune humano funcional se transfirió a animales inmunodeficientes través de la administración de células mononucleares de sangre periférica humana. La transferencia de células linfoblastoides B transformadas por VEB también indujo la enfermedad linfoproliferativa por VEB en este modelo. Por último, la administración intraperitoneal de pamidronato generó una expansión de células T Vγ9Vδ2 humanas in vivo, reducción de la incidencia y volumen del tumor y una supervivencia más prolongada.
El pamidronato es un antiguo fármaco que se utiliza ampliamente. Con sus propiedades inmunológicas recién descubiertas, podría representar una estrategia específica y relativamente sencilla para la prevención o tratamiento de la enfermedad linfoproliferativa posttrasplante, en asociación con células hematopoyéticas y el trasplante de órganos sólidos.
En el trasplante de células hematopoyéticas, otro tratamiento realizado con cierto éxito, permite la generación de clones de células T específicas para el VEB con la finalidad de reconstituir inmunidad contra el virus. Sin embargo, esta estrategia es cara y requiere tecnologías que suelen no estar disponibles. Esto tampoco ha sido fácil de implementar en el trasplante órganos sólidos, en donde es necesario controlar la inmunosupresión para prevenir el rechazo del órgano trasplantado.
En un reciente estudio preclínico, Ida Ricciardelli y co-investigadores (Blood 2014; 124:2514-22) han superado esta limitación a través de la ingeniería ex vivo de células T citotóxicas para VEB de modo que se vuelvan resistentes al tacrolimus, un agente inmunosupresor. Al usar un modelo de ratón inmunodeficiente para enfermedad linfoproliferativa VEB similar pero no idéntico al utilizado por el equipo de Xiang, los investigadores encontraron que la transferencia de células T citotóxicas inducían una regresión dramática del linfoma, a pesar de la presencia del tacrolimus.
Estos enfoques experimentales pueden representar opciones de tratamiento para la enfermedad linfoproliferativa postrasplante sin la problemática de la inmunosupresión. Ambos estudios se basan en trabajos previos, y los dos utilizaron buenos modelos de enfermedad humana. Sin embargo, la generación de células T citotóxicas específicas VEB es costosa. Aunque el pamidronato es barato y fácilmente disponible, su respuesta es variada de acuerdo con el número y la extensión de la activación de células T Vγ9Vδ2. En el futuro, de estos dos enfoques, probablemente se realicen de forma complementaria con otras terapias.
Fuente bibliográfica
New Approaches to Treating B-Cell Cancers Induced by Epstein–Barr Virus
Vikas R. Dharnidharka, M.D., and Thallachallour Mohanakumar, Ph.D.
Department of Pediatrics, Division of Pediatric Nephrology (V.R.D.), and the Departments of Surgery and Pathology and Immunology (T.M.), Washington University School of Medicine, St. Louis.
N Engl J Med 2015; 372:569-571


