Analgesia: la exquisita especificidad de la naturaleza
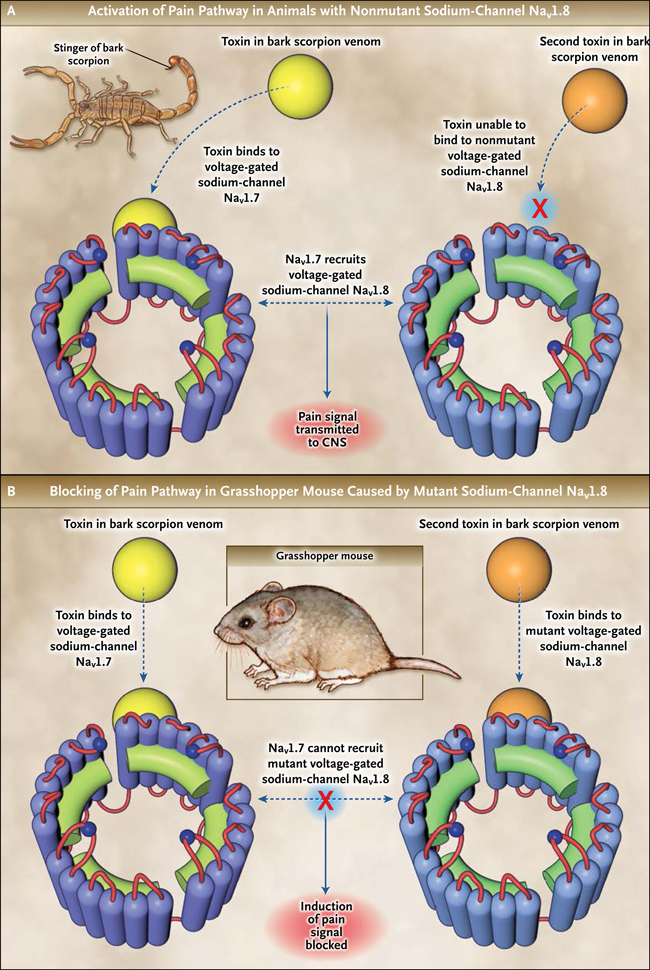
Los venenos dolorosos se utilizan para disuadir a los depredadores. El dolor en sí, sin embargo, puede ser señal de daño y por lo tanto representa una función adaptativa importante. En general, reducir la respuesta al dolor, aunque valiosa para protegerse de las especies venenosas, es poco frecuente, probablemente debido a que aumenta el riesgo de disminución de la respuesta al daño tisular. Se sabe, que una especie de escorpión capitaliza la vía del dolor de protección de los depredadores infligiendo picaduras intensamente dolorosas. Sin embargo, los ratones saltamontes los atacan regularmente y depredan a los escorpiones. El veneno de escorpión induce dolor en muchos mamíferos (ratones, ratas de casa, seres humanos) mediante la estimulación del canal de Na+ activado por voltaje Nav1.7 (la pérdida de su función provoca la falta de sensación de dolor), pero no tiene efecto en Nav1.8.
Comprender el papel de los canales del sodio voltaje dependientes en la nocicepción nos aclararía muchos mecanismos relacionados con el dolor. Estos canales son importantes para la transmisión del impulso nervioso, pudiendo representar objetivos diana para los analgésicos. Conocer las mutaciones en Nav1.7 en humanos ha permitido relacionarlas con diferentes formas clínicas; por ejemplo, el dolor crónico severo en pacientes que expresan tales mutaciones de un modo autonómico dominante; además, alteraciones recesivas en Nav1.7 generan la imposibilidad de sentir dolor alguno.
Resultados en analgesia
Ashlee H. Rowe y colaboradores (Science 2013; 342:441-446) recientemente han descubierto un contundente e instructivo ejemplo de selección evolutiva para la comprender la sensación de dolor. Los escorpiones producen un veneno que causa dolor severo y por tanto disuade a los depredadores. Sorprendentemente, los ratones saltamontes carnívoros que viven en el desierto tienen tendencia por los escorpiones y no se ven afectados por lo que otros animales perciben como picaduras intensamente dolorosas (figura 1). En estos ratones, el gen en las neuronas periféricas que codifica el canal de sodio dependiente de voltaje NaV1.8, que normalmente participa en la entrada nociceptiva, está mutado. Esta forma mutante se une y es inhibida por péptidos de la toxina del escorpión (figura 2). Las vías periféricas del dolor son así silenciadas, la picadura es ineficaz, y el ratón puede comerse al escorpión. Otros animales, incluyendo los seres humanos y los ratones de casa, sufren un dolor insoportable con este tipo de picaduras, debido a un componente peptídico distinto del veneno que activa el canal de sodio neuronal periférico NaV1.7. ¿Podría NaV1.8 representar una posible vía para prevenir el dolor en seres humanos?

Muchas compañías farmacéuticas se están centrando en NaV1.7 intentando desarrollar nuevos analgésicos, ya que los seres humanos con la pérdida de la función de las variantes no tienen dolor, pero para lo demás son normales. Las toxinas de las tarántulas y ciempiés contienen péptidos que son potentes analgésicos y selectivos bloqueadores de NaV1.7. ¿Podría ser que éstos enmascaren el efecto de una picadura tóxica para que la presa no trate de escapar? El equipo de Ashlee H. Rowe sugiere que esta nueva comprensión del bloqueo de NaV1.8, combinado con penetraciones en el sitio de unión del veneno, podría contribuir al desarrollo de fármacos analgésicos. Aunque ellos han dilucidado la estructura de NaV1.8 al sitio de unión al veneno, la estructura del péptido del veneno que inactiva a NaV1.8 en el ratón saltamontes aún no se ha identificado. Sin embargo, se ha podido identificar una conotoxina aislada de caracoles que bloquea los canales Nav1.8 humanos y que también es analgésica. Otros ejemplos de péptidos potentemente analgésicos se han descrito recientemente, incluyendo componentes altamente activos en el veneno de la serpiente mamba negra.
¿Por qué las criaturas venenosas son mejores que los químicos medicinales en la producción de analgésicos selectivos? Una de las razones es que son el producto de millones de años de evolución selectiva. ¿Por qué no utilizar tales toxinas como analgésicos en la práctica clínica? Las toxinas son muy difíciles de producir a bajo precio porque se necesita introducir grupos sulfhidrilos adecuados para activar las secuencias de péptidos. Dada la variedad de los objetivos definidos por los estudios de analgésicos a partir de toxinas (o venomics), ¿qué tanto los datos actuales apoyan la idea que un ataque contra NaV1.8 aliviaría el dolor humano?
Los estudios en ratones han demostrado que NaV1.8 es importante para sentir dolor a temperaturas frías, dolor visceral, dolor mecánico y en neuronas sensoriales periféricas, y que el bloqueador conotoxina relativamente selectivo de NaV1.8 es eficaz en el alivio de dolor inflamatorio y neuropático. Sin embargo, la supresión de NaV1.8 en ratones no bloquea el dolor tan eficazmente como la supresión de NaV1.7, y sólo un tipo de dolor causado en seres humanos se ha relacionado a mutaciones que aumentan el dolor vía NaV1.8. En humanos, no han sido identificados mutantes NaV1.8, la evidencia sugiere que NaV1.7 sigue siendo el mejor objetivo. Algunos pequeños bloqueadores de NaV1.8 han sido evaluados, y antagonistas no selectivos de Nav1.7 sólo se encuentran actualmente en ensayos de fase 2, lo que significa que pasarán algunos años antes que podamos tener fármacos clínicamente útiles que actúen sobre NaV1.7.
Es preocupante que una masa molecular relativamente grande de toxinas analgésicas que interactúan en múltiples sitios en los canales de iones signifique que las pequeñas moléculas nunca puedan recapitular la selectividad de los productos naturales. Si esto es cierto, entonces los datos de un determinado veneno pueden ser más útiles en términos de validación de objetivos, necesitándose enfoques más innovadores para el desarrollo de medicamentos analgésicos. Comprometer la función del canal por la inhibición selectiva de la expresión génica puede parecer imaginario; también lo es la expectativa que las compañías farmacéuticas produzcan fármacos que imiten la exquisita especificidad de los productos naturales.
Fuente bibliográfica
Results in Analgesia — Darwin 1, Pharma 0
John N. Wood, Ph.D.
University College London, London.
N Engl J Med 2013; 369:2558-2560


