Inmunidad vaccínea: más allá de los peajes
INTRODUCCIÓN
Contrariamente a lo que podría parecer, el nombre de los receptores tipo Toll-like (“tipo peaje”) no proviene del inglés, es circunstancial y no tiene nada que ver con las características biológicas ni funcionales de la molécula. Su nombre lo acuñó el bioquímico Christiane Nüsslein-Volhard a partir de la palabra alemana Toll, que significa “imposible” o “que locura”. Se identificaron como moléculas esenciales que determinan el eje dorso-ventral durante el desarrollo embrionario de la mosca de la fruta (Drosophila melanogaster). Luego se observó que un Toll no sólo tenía funciones de carácter embrionario, sino que también poseía acciones inmunes, al comprobar que las moscas que carecían de ellos, morían debido a infecciones fúngicas. En 1997, Ruslan Medzhitov identificó el primer homólogo humano del receptor Toll denominándolo receptor Toll-like (TLR, por sus siglas en inglés). Se trata una familia de proteínas trasmembrana de tipo I que forman parte del sistema inmunitario. Son responsables del reconocimiento de varias vías de patrones de reconocimiento de patógenos (PAMPs pathogen-associated molecular patterns) expresados por un amplio espectro de agentes infecciosos. Monocitos, macrófagos y neutrófilos fagocitan patógenos microbianos y estimulan la respuesta de citoquinas dando como resultado el desarrollo de la inmunidad innata o natural, la respuesta inflamatoria y median la efectiva inmunidad adaptativa. Su función, en resumen, es el reconocimiento del patógeno y la estimulación de la respuesta inmunológica contra dichos patógenos. Tienen un origen evolutivo muy antiguo; después de las defensinas, pueden ser el componente más antiguo del sistema inmune.
Los distintos TLR exhiben varios patrones de expresión aunque principalmente actúan como homodímeros. Las proteínas TLR tienen una significativa homología con el receptor IL-1 tipo I. Se han descrito unos doce TLR en humanos y en ratón. Estudios con varios TLR demuestran que activan la vía del NF-kB, a través de varias moléculas como el MyD88, TIRAP/Mai y TRF. La activación de la vía del NF-kB conduce a la iniciación de la respuesta adaptativa inmune por la producción de citoquinas inflamatorias tales como IL-1, IL-8, TNF-alfa, IL-12, y la inducción de moléculas de co-estimulación, como la CD80, CD86 y CD40.
Por otra parte, las vacunas inactivadas requieren agonistas inmunes (inmunopotenciadores o adyuvantes) para determinar el tipo de inmunidad inducida (Th1 o Th2) y promover la respuesta inmunológica. La caracterización de los receptores TLR en la inmunidad natural y los componentes co-estimulantes de la inmunidad adquirida ha posibilitado identificar nuevos agonistas, establecer las relaciones entre estructura y función, y elaborar fármacos con mejores propiedades. Debido a que los agonistas también pueden modificar la producción de linfocitos T citotóxicos (LTC), su selección es crítica para la efectividad vaccínea. Si bien la síntesis de LTC constituye un objetivo para las vacunas, en donde la muerte de las células blanco es una meta en sí misma (como en las vacunas oncológicas), para otras vacunas esto se complica debido a las potenciales exacerbaciones que puedan promover enfermedades como la hepatitis y el Alzheimer, en donde la producción de LTC debe evitarse. El descubrimiento de que los agonistas, al actuar sobre diferentes receptores, pueden aumentar sinérgicamente la inmunidad, ha abierto nuevas posibilidades para la síntesis de nuevas vacunas. La comprensión de los mecanismos inmunomoduladores de los agonistas también sustentará la utilización de estos agentes como tratamientos independientes.
Sobre los coadyuvantes
De todas las medidas sanitarias públicas contra las infecciones, podría decirse que la vacunación es la menos rentable. La mayoría de las vacunas pueden ser divididas en dos tipos: vacunas vivas o atenuadas; y vacunas muertas o inactivadas (no-replicantes). Las vacunas inactivadas, tales como la de la hepatitis B, consisten generalmente en componentes del patógeno, denominados subunidades vaccíneas. Punto crítico del efecto protector de las subunidades son los añadidos llamados coadyuvantes, que amplifican la respuesta inmune. Actualmente, una sustancia basada en una sal de aluminio llamada alumbre y otra a base de aceite denominada MF59 son los dos coadyuvantes permitidos para el uso clínico. Estos componentes son extremadamente importantes para la generación de una potente inmunorespuesta frente a un antígeno, pero, en gran parte, se ignora cómo trabajan. Un estudio reciente de Amanda L. Gavin y colaboradores (Adjuvant-enhanced antibody responses in the absence of toll-like receptor signaling. Science 2006; 314:1936-8) evaluó el mecanismo de la acción de estos compuestos.
La primera respuesta del anfitrión a la vacunación se llama la inmunorespuesta innata, un sistema de defensa evolutivamente muy antiguo que ocurre dentro de los primeros minutos u horas después de la vacunación. Las células dendríticas son capaces de “girar” respecto a esta respuesta. Pueden detectar componentes bacterianos, de virus, de parásitos y de hongos a través de los denominados receptores de reconocimiento del patógeno (RRP). Una subclase de receptores que reconocen patógenos es el receptor tipo Toll (Toll-like Receptors, TLR). Por lo menos se han descrito 10 TLR en humanos; colectivamente, detectan una amplia gama de estímulos microbianos. Por ejemplo, el TLR4 detecta lipopolisacáridos, el TLR9 reconoce ADN viral y bacterial, y TLR3 y TLR7/8 detectan el ARN de doble y una cadena, respectivamente. El TLR intracelular presente en las células dendríticas está controlado al menos por cuatro proteínas adaptadoras, incluyendo MyD88 y TRIF. Una vez que las células dendríticas descifran e integran las señales generadas por las moléculas microbianas con los TLR, transportan esta información a las células T antígeno-específicas, generando así una inmunorespuesta. Por lo tanto, no sorprende, entonces, que se pueda considerar una estrategia de vacunación con mecanismos relacionados a los TLR. Una búsqueda bien centrada está en curso para ligandos sintéticos que estimulan de forma específica a los TLR y por lo tanto representan potenciales coadyuvantes vaccíneos.
Gavin y su equipo se preguntaron si las señales de los TLR son esenciales para la elicitación de la inmunidad inducida mediante coadyuvantes. Para responder lo anterior, ellos estudiaron en ratones las respuestas de anticuerpos a dos antígenos diferentes y altamente inmunogenéticos, la hemocianina (Hy) y la hemocianina de lapa californiana (KLH), que químicamente están unidas al trinitrofenol (TNP). Fueron administrados en cuatro tipos de coadyuvantes: alumbre, coadyuvante de Freund completo, coadyuvante de Freund incompleto y Ribi.
Primero, inmunizaron ratones normales (tipo salvaje) y ratones incapaces de retransmitir señales de TLR (animales “knockout” deficientes en los genes que codifican para MyD88 y TRIF) con TNP-Hy administrado con el coadyuvante de Freund completo, que contiene varios ligandos de TLR. Sorpresivamente, observaron que las respuestas del anticuerpo eran similares en los ratones tipo salvaje y en los “knockout” (figura 1). Aún cuando las respuestas primarias del anticuerpo fueron aumentadas con una inmunización de recuerdo (“booster”), los títulos del anticuerpo en los ratones mutantes fueron similares a los animales normales. Gavin y colaboradores observaron resultados similares cuando TNP-Hy también era administrado en el alumbre, que se pensaba no contenía ningún ligando de TLR.
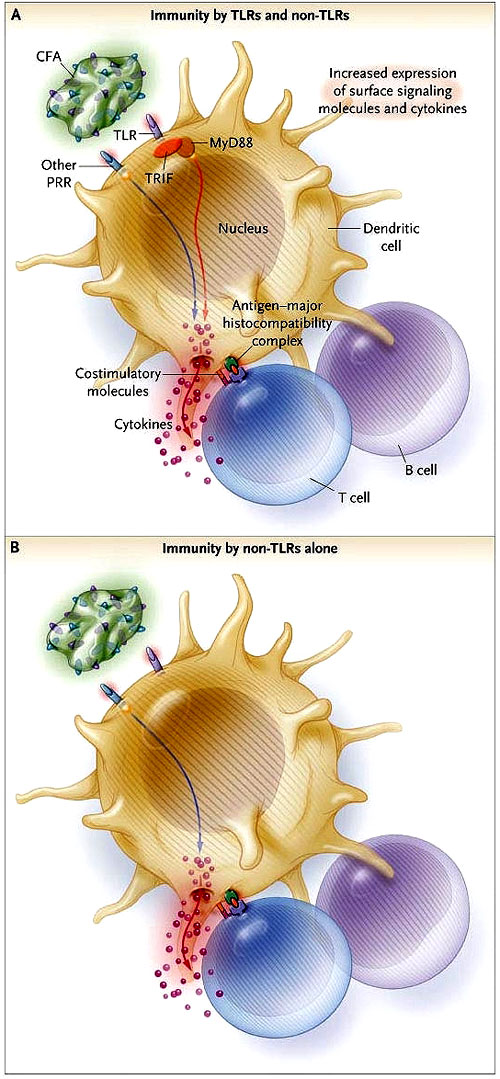
Las células dendríticas pueden detectar los componentes microbianos (contenidos dentro de los coadyuvantes) a través de los receptores de reconocimiento de patógenos (RRP), de los cuales los Toll-like (TLR) son un subgrupo. Las señales provocadas por un patógeno a través de los PRR en la superficie celular o dentro de la célula acciona una serie de acontecimientos intracelulares, incluyendo aumento en la expresión de citoquinas y de moléculas estimulantes, que da lugar en última instancia al estímulo de las células T y B antígeno-específicas (es decir, una respuesta inmunológica adaptativa contra el patógeno). A nivel de investigación, los esfuerzos se han centrado en optimizar la eficacia vaccínea mediante la colocación del complemento de los ligandos TLR en los coadyuvantes. En contraste con las células dendríticas de los ratones tipo salvaje (panel A), los animales deficientes en proteínas adaptadoras MyD88 y TRIF tienen dañada la señalización TLR (panel B). No obstante, ambos tipos de ratones presentaron una potente inmunorespuesta al antígeno en el coadyuvante de Freund completo, sugiriendo que los no-TLR son suficientes para activar las células dendríticas y estimular la inmunidad de las células B.
Los autores, entonces, probaron el efecto de TNP-KLH administrado en los mismos tres coadyuvantes: coadyuvante de Freund completo, coadyuvante de Freund incompleto y Ribi (que contenía un ligando TLR4). La respuesta del anticuerpo a TNP-KLH en presencia de Ribi fue menor en los ratones “knockout”, pero las respuestas inducidas por el coadyuvante de Freund incompleto (no contendría ningún ligando TLR) y completo fueron intactas 7 y 14 días después de la inmunización. Los investigadores concluyeron que la señalización TLR no es esencial para la inducción de una respuesta del anticuerpo contra el antígeno administrado en alumbre, en coadyuvante de Freund completo, incompleto y Ribi.
Sería importante determinar si estos son aplicables para los coadyuvantes administrados con proteínas poco inmunogenéticas y si los TLR son importantes para el desempeño de vacunas clínicamente relevantes. En este contexto, un reciente estudio sugiere que la inducción de la inmunidad por la vacuna viva (17D) atenuada para la fiebre amarilla, una de las vacunas más eficaces, es dependiente de señales TLR.
¿En qué medida los resultados del equipo de Amanda Gavin cambian la perspectiva que los TLR son críticos para la inducción de una inmunorespuesta adaptativa? Respecto a esta pregunta, es importante distinguir entre la capacidad y la necesidad. ¿Son los TLR capaces de inducir una inmunidad adaptativa? La respuesta es sí: la evidencia indica que los ligandos específicos para los TLR pueden inducir una fuerte activación de las células inmunes naturales y el subsiguiente estímulo para una contundente respuesta inmunológica. Por ejemplo, el ADN de CpG, un ligando TLR9 que se administra con la vacuna de la hepatitis B, es capaz de aumentar los títulos del anticuerpo y el porcentaje de pacientes en quienes la respuesta del anticuerpo se desarrolla. ¿Son necesarios tales factores para una inmunorespuesta vacuna-inducida? No siempre, según lo demostrado en el estudio de A. Gavin. Es probable que otros receptores estén implicados, es evidente la existencia de otras familias de receptores de reconocimiento de patógenos. Está claro, finalmente, la necesidad de una mejor comprensión de los receptores de reconocimiento de patógenos.
Fuente bibliográfica
Tolls and beyond--many roads to vaccine immunity.
Bali Pulendran, Ph.D.
Emory Vaccine Center, Emory University, Atlanta, USA.
N Engl J Med. 2007 Apr 26;356(17):1776-8