Reparando la retina
INTRODUCCIÓN
Principalmente, hoy en día, existen dos aproximaciones para el tratamiento de enfermedades neurodegenerativas de la retina: la genética y la celular. La primera, ha proporcionado una nueva perspectiva de la fisiología y patogénesis de algunas patologías retinianas de base genética, y su manejo por modificación de los genes involucrados. Si bien se han logrado grandes avances a través de modelos animales (incluso en fase de investigación clínica para la amaurosis congénita de Leber), la terapia génica no parece ser una vía cercana en enfermos con una importante falla visual como resultado de la pérdida de los fotorreceptores o de células del epitelio pigmentario retiniano. Además, su aplicación se complica en patologías con gran cantidad de factores etiológicos y patogénicos, como la DMAE y es altamente costosa en condiciones con un innumerable número de genes implicados, como la retinosis pigmentaria.
Por otra lado, según la terapia celular, la realización de trasplantes retinianos a nivel cerebral ha demostrado ser capaz de generar capacidad de crecimiento axonal con establecimiento de sinapsis y respuestas fisiológicas. Así, se cree que si el trasplante se realiza a nivel subretiniano podría ser posible que las células establecieran nuevas conexiones sinápticas y tuvieran capacidad funcional. En esta área, existen dos aproximaciones: evitar la pérdida de fotorreceptores introduciendo células que los mantengan funcionales y reemplazar los fotorreceptores perdidos. Las dos alternativas tienen problemas similares, por ejemplo, elegir el tipo celular adecuado, el método de trasplante, minimizar la reacción inflamatoria postoperatoria y la respuesta inmune, el modo de realización del trasplante, optimizar su eficacia y la valoración del éxito postoperatorio.
El primer trasplante retiniano se realizó hace 60 años, pero el máximo interés se adquiere en la década de los 80. Los primeros resultados en animales provocaron un gran entusiasmo, sin embargo aún existen muchas dudas por dilucidar. En personas, los primeros se llevaron a cabo en los 90, comprobándose su seguridad, pero sin grandes resultados funcionales. En la actualidad, la mayoría de los grupos que realizan trasplantes opinan que se necesita más investigación básica para profundizar sobre la técnica y sus beneficios.
También existe otro método asociado a la terapia celular: la inyección de células madre, con capacidad de ayudar a la permanencia celular y reemplazar fotorreceptores perdidos. Se han utilizado células madre embrionarias humanas o células madre de la médula ósea que inyectadas en el espacio subretiniano han mostrado capacidad para diferenciarse en neuronas e integrarse en los circuitos retinianos. De igual forma, es necesario un incremento de la investigación para conocer los mecanismos involucrados en la diferenciación, integración y funcionalidad de las células trasplantadas.
Finalmente, han existido grandes avances en los trasplantes retinianos en las últimas dos décadas. Los equipos de investigación continuarán estudiando las características de las células del fotorreceptor y de los modelos de ratón para aprender más sobre el proceso del trasplante y de integración funcional. Quizás durante los próximos cinco años se comenzarán a ver los primeros resultados en personas con diferentes grados de ceguera.
Células progenitoras retinianas - la sincronización es clave
Más de 10 millones de personas en los Estados Unidos son ciegas o tienen algún tipo de deterioro visual, y cada año, unas 50.000 padecerán privación total de la vista. Los resultados de una evaluación realizada por la fundación americana para la ceguera indican que los diabéticos tienen más posibilidades de quedar ciegos que sufrir una muerte prematura. La reparación retiniana por medio del trasplante de los precursores del fotorreceptor, recientemente descrito por Robert MacLaren y colegas (MacLaren RE, Pearson RA, MacNeil A, et al. Retinal repair by transplantation of photoreceptor precursors. Nature 2006; 444:203-7), conlleva la esperanza de mucha gente.
La ceguera es causada a menudo por condiciones degenerativas en las cuales las células sensoriales de la retina se deterioran y mueren. Tales circunstancias incluyen retinosis pigmentaria y degeneración macular relativa a la edad. Los fotorreceptores no se dividen después del nacimiento, y se cree que tampoco puedan ser naturalmente substituidos. Sin embargo, por décadas, los investigadores han probado la eficacia del trasplante retiniano para el tratamiento de la enfermedad de la retina de etapa avanzada. Los trasplantes de retinas, de capas retinianas y de grupos de neuronas retinianas han sido y continúan siendo practicados en ratones y en seres humanos con retinosis pigmentaria y degeneración macular relativa a la edad. Estos trasplantes no causan daño, pero no hay evidencia que las células trasplantas se mezclen o desarrollen conexiones sinápticas con las células del huésped.
La clave, según MacLaren y colaboradoes, es la sincronización (tiempo en que se obtienen las células a partir del donante, así como también, su madurez correcta), una etapa en la cual han salido del ciclo celular y han derivado hacia fotorreceptores maduros, los cuales pueden ser integrados en retinas enfermas neonatas o adultas. Si estas células se aíslan demasiado temprano o demasiado tarde, no se integrarán. Cuando el grupo de MacLaren introdujo el tejido celular en la etapa correcta en retinas de dos distintos modelos animales para la retinosis pigmentaria (figura 1), no sólo las células se convirtieron en fotorreceptores maduros sino que los ojos tratados también demostraron mejores respuestas luminosas de la pupila. Estos resultados sugirieron que las células trasplantadas son capaces de responder a la luz y de integrarse dentro del circuito que conectaba las células retinianas con las células del sistema nervioso central. La respuesta pupilar a la luz es una de las muchas medidas de resultado para la función retiniana y visual; lo que probablemente se utilizará para evaluar futuros tratamientos. Los ratones con mejores respuestas no parecían tener más beneficios de tratamiento en términos prácticos, por ejemplo, no poseían una capacidad mejorada de desplazarse o de seguir un objeto móvil. Por esto último, los resultados del estudio de MacLaren y colegas naturalmente conducen a la especulación sobre el posible tratamiento de la ceguera en seres humanos.
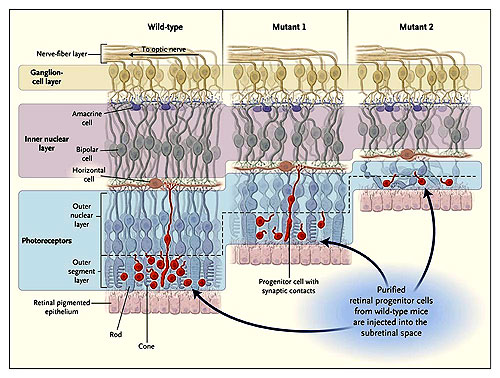
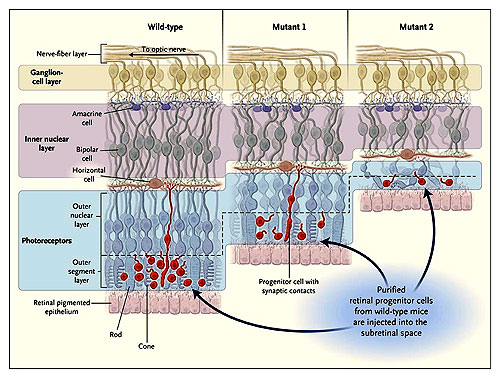
Imágenes esquemáticas de secciones de las retinas en ratón tipo salvaje (izquierda) y en dos ratones mutantes con degeneración retiniana (derecha). Las flechas indican las capas correspondientes en las retinas de ratones rho +/- (mutante 1) y rd (mutante 2). La degeneración del fotorreceptor da lugar al adelgazamiento de las capas nucleares externas y segmentos externos (juntos abarcan los fotorreceptores); esto hace que la toda la retina llegue a ser más fina. MacLaren y colaboradores inyectaron células progenitoras retinianas purificadas de ratones salvajes (rojos) en el espacio subretinal de ratones salvajes y mutantes. Tres semanas después, los autores observaron que una pequeña porción de células progenitoras habían emigrado en la retina y se habían establecidos uniones sinápticas con las células en la capa nuclear interna de los animales salvajes y mutantes 1. Los ratones mutantes 1 tenían un índice comparativamente menor de degeneración retiniana, y el trasplante ocurrió en la primera fase de la enfermedad, dando por resultado una mejor función visual. En cambio, la mayor parte de las células progenitoras inyectadas en los ratones mutantes 2, que padecían de degeneración retiniana más severa, no migraron dentro de la retina.
¿Cuál sería la mejor fuente de células precursoras para el tratamiento de la ceguera humana? Si las retinas fetales de humanos fueran utilizadas como células progenitoras, el momento óptimo de obtenerlas probablemente estaría entre la 11 y 15 semanas de gestación. Durante este período, la mitosis de las células neuronales cesa, y éstas comienzan a madurar en fotorreceptores. No es correcto pensar que el tejido fetal no se puede utilizar para tal propósito. Puede, pero el uso de este tejido debe plantearse mediante regulaciones legales, incluyendo lo referente al consentimiento informado, secreto y mediante aprobación de la institución o de las instituciones en donde se obtengan las muestras y ocurra el trasplante. De hecho, los ensayos con células retinianas fetales están en curso.
Para evitar molestias burocráticas, falta de previsión en la disponibilidad de tejido y factores desconocidos implicados en la purificación celular, Deepak A. Lamba y colaboradores (Lamba DA, Karl MO, Ware CB, Reh TA. Efficient generation of retinal progenitor cells from human embryonic stem cells. Proc Natl Acad Sci U S A 2006; 103:12769-74) han sugerido alternativas. Incubaron células madre embrionarias humanas en un complejo cóctel que permitió transformarlas en progenitores del fotorreceptor. Estos precursores, como en los descritos por MacLaren, podían integrarse en las retinas aisladas de ratón. De esta manera, es posible preparar números ilimitados de células progenitoras para un trasplante.
¿Sin importar si tales células se aíslan de tejido humano o de células madre embrionarias, cómo se puede asegurar suficiente número de unidades madre para un transplante eficaz? El grupo de MacLaren concluyó que no es necesario integrar cada precursor celular con cada neurona secundaria para alcanzar un efecto terapéutico. También, puede no ser importante tratar toda la retina; el manejo sólo de la mácula puede ser suficiente. Un importante desafío, sin embargo, es la eficacia de la integración del progenitor. MacLaren y colegas observaron que solamente el 0.03 al 0.1% de las células trasplantadas se integraron en la retina e hicieron conexiones sinápticas con las células huésped. Las células restantes terminaron la diferenciación en el espacio subretinal. El efecto sobre la restauración de la función visual habría sido probablemente mucho mayor si una proporción más grande de estas células hubiese sido integrada. Quizás la incorporación se puede mejorar con manipulaciones adicionales de las células progenitoras o de las células madre embrionarias humanas para que expresen sistemas de genes que promuevan la diferenciación y la integración.
¿Se podrían utilizar los trasplantes de precursores retinianos para tratar seres humanos con ceguera? La investigación de MacLaren demostró que los trasplantes se integraron con eficacia en las retinas de ratones con retinosis pigmentaria. Sin embargo, los investigadores tuvieron un éxito limitado con un tercer conjunto de animales, probablemente porque el modelo implicó la rápida degeneración retiniana y una falta de sustento para las células trasplantadas. Otros estudios están evaluando los efectos potenciales de las etapas del tejido del anfitrión en el trasplante, y los resultados pueden ayudar a determinar si los seres humanos en fases análogas de degeneración retiniana podrían beneficiarse de este acercamiento.
¿Esta técnica puede ser utilizada para repoblar otras áreas del ojo y otros órganos? Los resultados de los grupos de Robert MacLaren y de Deepak A. Lamba desafían la teoría que las células indiferenciadas son ideales para los trasplantes. Teóricamente, las células progenitoras que dan origen a otros tipos de células más diferenciadas se podrían aislar o generar para poblar un tejido receptor diferente. Por ejemplo, puede ser posible aislar células progenitoras retinianas que se convertirán en fotorreceptores de conos en vez de fotorreceptores de bastones. Los fotorreceptores de los conos median la visión del color y la visión fina, a diferencia de los fotorreceptores de los bastones, que median la visión de luz tenue. En el mundo industrializado, donde es rara la iluminación débil, puede ser más importante sustituir fotorreceptores de los conos que fotorreceptores de los bastones. Similarmente, se podrían idear experimentos para determinar si los progenitores “diferenciados”, análogos a los descritos en las investigaciones, pueden tener un efecto terapéutico en modelos para la enfermedad de Parkinson o para otras condiciones neurodegenerativas.
Fuente bibliográfica
Retinal Progenitor Cells — Timing Is Everything
Jean Bennett, M.D., Ph.D.
Scheie Eye Institute, University of Pennsylvania, Philadelphia, USA.
N Engl J Med. 2007 Apr 12;356(15):1577-9.