Caballos troyanos, liposomas y compañía
INTRODUCCIÓN
Las bacterias que pueden producir infecciones mortales en humanos y animales prometen tratar el cáncer "comiendo" los tumores desde adentro hacia afuera. Recientes estudios han demostrado una significativa mejora en las perspectivas de la terapia bacteriana para la erradicación del cáncer, si ésta se combina con un fármaco especialmente empaquetado. En experimentos con ratones, se ha demostrado que una bacteria modificada genéticamente tiene un gusto especial por los ambientes privados de oxígeno, tales como el centro de los agrupamientos de células cancerígenas. Estas agentes son en sí mismos relativamente inofensivos, pero sus contrapartes no modificados producen elementos tóxicos que han causado la muerte de algunos humanos al ser introducidas en el torrente sanguíneo.
Los efectos aniquiladores de estos gérmenes en el cáncer fueron descubiertos hace cinco años, cuando un equipo del Centro Oncológico Kimmel de Johns Hopkins (Baltimore, Estados Unidos) observó la capacidad que tenían para crecer y propagarse en el núcleo poco oxigenado de los tumores de ratones y las cicatrices oscuras que indicaban la destrucción del cáncer. Las células normales circundantes habían permanecido sin mayor alteración, pero las bacterias no lograron destruir las unidades cancerígenas en los bordes de los tumores, todavía ricos en oxígeno. En respuesta a ello, el equipo agregó una quimioterapia especialmente encapsulada, postulando que ciertas propiedades de las bacterias mejorarían la eficacia del fármaco. La técnica combinada erradicó temporalmente los tumores grandes y pequeños de casi 100 ratones y curó en forma permanente a más de dos tercios de ellos.
La posible explicación de la mayor destrucción de células cancerígenas por medio del tratamiento combinado es que las bacterias exponen los tumores a una cantidad de quimioterapia seis veces mayor que la habitual al mejorar la descomposición y dispersión del empaquetado graso de la quimioterapia en la zona tumoral. Los medicamentos oncológicos "empaquetados" actualmente están disponibles en cápsulas grasas microscópicas llamadas liposomas que gravitan hacia los tumores porque son demasiado grandes para pasar entre los vasos sanguíneos estrechamente entrelazados que rodean el tejido normal y lo bastante pequeñas para pasar a través de la vasculatura tumoral. Combinar bacterias modificadas y liposomas llenos de agentes quimioterapéuticos parece tener un efecto sinérgico en los tumores debido a la presencia de una enzima apodada liposomasa. Ésta destruye las membranas grasas y puede afectar la capa externa de los liposomas liberando el fármaco que contienen.
Los fármacos alojados en los compartimentos de estos 'caballos troyanos' son liberados específicamente en la zona tumoral por las bacterias mejorando la eficacia y seguridad de la terapia. La liposomasa podría utilizarse en otras terapias dirigidas, además de la combinación bacteriana. Podrían incluir, por ejemplo, fijar la liposomasa a anticuerpos que tienen afinidad con tumores específicos o agregar su código de ADN a la terapia génica. Actualmente se realizan pruebas de seguridad preliminares que involucran la inyección de sólo la bacteria a un reducido número de pacientes con cáncer.
CONTAMINANDO TUMORES PARA COLOCAR MEDICAMENTOS
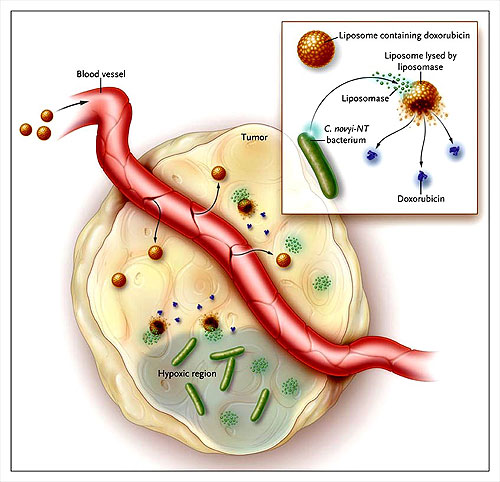
El dirigir drogas hacia los tumores ha sido una preocupación esencial de la farmacología por décadas. Tecnologías nuevas como los anticuerpos monoclonales para llegar a los tumores, lo mismo que portadores de drogas liposomales o nanopartículas representan importantes hitos en busca de este objetivo. Un estudio reciente de Ian Cheong y colaboradores (A bacterial protein enhances the release and efficacy of liposomal cancer drugs. Science 2006; 314:1308-11), representa una nueva orientación a la dirección de drogas a los tumores lo que lograron usando bacterias para liberar drogas liposomales dentro del tumor (figura 1).
El grupo de Cheong utilizó el Clostridium novyi NT, un anaerobio obligado que puede colonizar drogas hipóxicas de un tumor. Este germen tiene propiedades líticas que los autores pensaron utilizar para liberar drogas liposomales dentro de tumores. El Doxil es una doxorrubicina incorporada dentro de un liposoma que tiene un largo periodo de circulación. Estos liposomas pueden penetrar al tumor a través de fenestraciones vasculares del endotelio que se encuentran en este tipo de tumores. Ellos se acumulan en el tejido neoplásico por intermedio del mecanismo llamado “efecto de permeación- retención exacerbada”.
Los autores usaron tumores en ratones inyectando esporas de C. novyi NT antes de tratarlos con Doxil y lo compararon con animales bajo doxorrubicina sola. Estudios de biodistribución demostraron que el tratamiento combinado aumentaba mucho más la concentración de droga en el tumor.
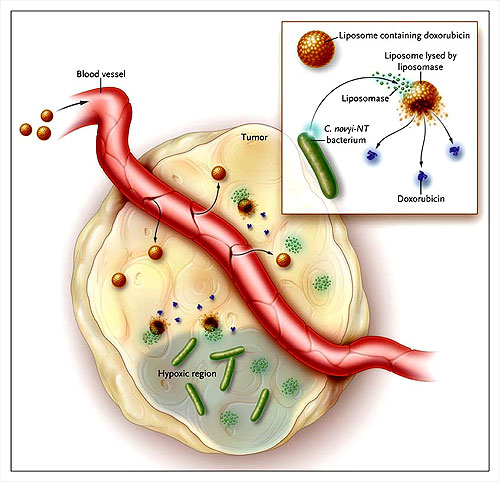
Cheong y colaboradores describieron una nueva técnica para el tratamiento del cáncer usando modelos en ratones. Doxil (doxorrubicina liposomal) es administrada al animal tratado previamente con el bacterio hemolítico Clostridium novyi NT. Los liposomas salen de los vasos por fenestraciones que existen a nivel del tumor donde se encuentran con una proteína, la liposomasa, secretada por la bacteria. La liposomasa libera la doxorrubicina de los liposomas dentro del tumor aumentando la concentración y efecto terapéutico de la droga.
Ellos sospecharon y comprobaron que el uso del Doxil se debía a la secreción de una lipasa producida por un gen del bacterio. Al clonar la secuencia génicas se obtuvieron mutantes sin actividad lipásica. Sorprendentemente, Cheong y colegas, no encontraron correlación entre la actividad de la lipasa y la capacidad de liberar doxorrubicina de los liposomas. Investigaciones posteriores comprobaron que la proteína codificada por el NT01CX2047 que es el gen del Clostridium podía romper la doble membrana lipídica, independientemente de su capacidad enzimática. Los investigadores llamaron a esta proteína “liposomasa” por su capacidad de liberar drogas de los liposomas.
El descubrimiento de Cheong abre nuevas posibilidades terapéuticas para el tratamiento del cáncer. Si bien a los humanos no se les podría inyectar Clostridium novyi, podría unirse la liposomasa bacterial a un anticuerpo con receptores de la superficie celular tumoral donde este pudiera acoplarse. Podrían usarse virus u otros vectores para incorporar la liposomasa dentro del tumor o por último usarse nanopartículas para provocar el efecto “permeación-retención exacerbada”. Un efecto no deseable sería que la liposomasa, que es una proteína bacteriana, tenga un efecto inmunogénico limitando así el número de cursos terapéuticos.
Además de sus implicaciones inmediatas para la investigación contra el cáncer, el informe del grupo de I. Cheong tiene lecciones más amplias para la ciencia biomédica contemporánea. Primero, existe una masiva inversión para generar nuevas y sofisticadas tecnologías que sustenten los estudios sobre el cáncer. Este esfuerzo está dando por un conjunto de nuevos acercamientos de gran alcance y de dispositivos basados en la nanociencia, incluyendo varios tipos de nanopartículas para la entrega de medicamentos. Sin embargo, estos procedimientos, de por sí ingeniosos, pueden ser mejorados como por ejemplo a través del uso de liposomas de largo tiempo de circulación. En todo caso, la optimización de la terapia iría por el camino de mejorar la identificación y características de los liposomas y de ahí mayores oportunidades del uso en clínica liberando liposomas purificados en el tumor. Segundo, este informe sirve como base proverbial para la investigación de translación. Una tentativa pragmática de mejorar una terapia antitumoral condujo a la investigación fundamental (identificación y caracterización de la liposomasa), que alternadamente proporciona oportunidades adicionales para el uso clínico (entrega de la liposomasa a los tumores).
Fuente bibliográfica
Bugging Tumors to Put Drugs on Target
Rudy Juliano, Ph.D.
Department of Pharmacology and the Carolina Center of Cancer Nanotechnology Excellence, School of Medicine, University of North Carolina, Chapel Hill, USA.
N Engl J Med. 2007 Mar 1; 356(9):954-5