La ruta de la osteoporosis
La osteoporosis, fragilidad ósea asociada a una menor calidad y cantidad ósea, es un problema importante en el envejecimiento de la población. En el transcurso de los años, el equilibrio entre la formación ósea y la resorción tiende a favorecer a esta última, lo que resulta en una menor masa y la alteración de la arquitectura ósea. In vitro, se ha observado que las células madre mesenquimales de médula ósea de pacientes con osteoporosis son más propensas a diferenciarse en adipocitos que osteoblastos, esto, en comparación con células aisladas de pacientes con masa ósea normal, y los huesos osteoporóticos tienden a acumular adipocitos en el espacio trabecular. Estos estudios y los datos de modelos animales para la osteoporosis han suscitado dudas sobre si el incremento de la médula ósea grasa es una consecuencia o es la causa de la disminución de la masa ósea en la osteoporosis.
Adipocitos y osteoblastos se diferencian de una célula precursora mesenquimal común. La evidencia experimental indica que existe un considerable grado de plasticidad entre los osteoblastos y los linajes de adipocitos. Incluso los osteoblastos completamente diferenciados derivados de células madre mesenquimatosas humanas son capaces de re-diferenciarse en adipocitos y condrocitos, y viceversa.
Nuevos objetivos para la osteoporosis
Una estrategia atractiva para el tratamiento de la osteoporosis ha sido el desarrollo de fármacos que se unen a receptores en las células osteoprogenitoras y coaxiales para que éstas puedan diferenciarse en osteoblastos en lugar de adipocitos. Tal estrategia se ha mantenido durante varias décadas, pero aún no se han elaborado terapias más eficaces. Un reciente estudio de Yanqiu Liu y colaboradores (J Clin Invest 2012; 122:3101-13) sugiere que posiblemente los esfuerzos se han centrado demasiado en los acontecimientos de la superficie celular. Algunos de acción real, y objetivos importantes de la enfermedad, podrían darse al interior del núcleo.
No existen grandes sorpresas en los experimentos iniciales realizados por estos autores. Mediante el uso de un protocolo bien establecido, ellos diseñaron ratones para que no expresaran el factor de crecimiento endotelial vascular A (VEGF-A) en las células progenitoras óseas. Los animales desarrollaron muchas de las características de la osteoporosis: una disminución del hueso trabecular, huesos corticales más delgados, y aumento de adipocitos asociados al hueso trabecular (fig. 1).
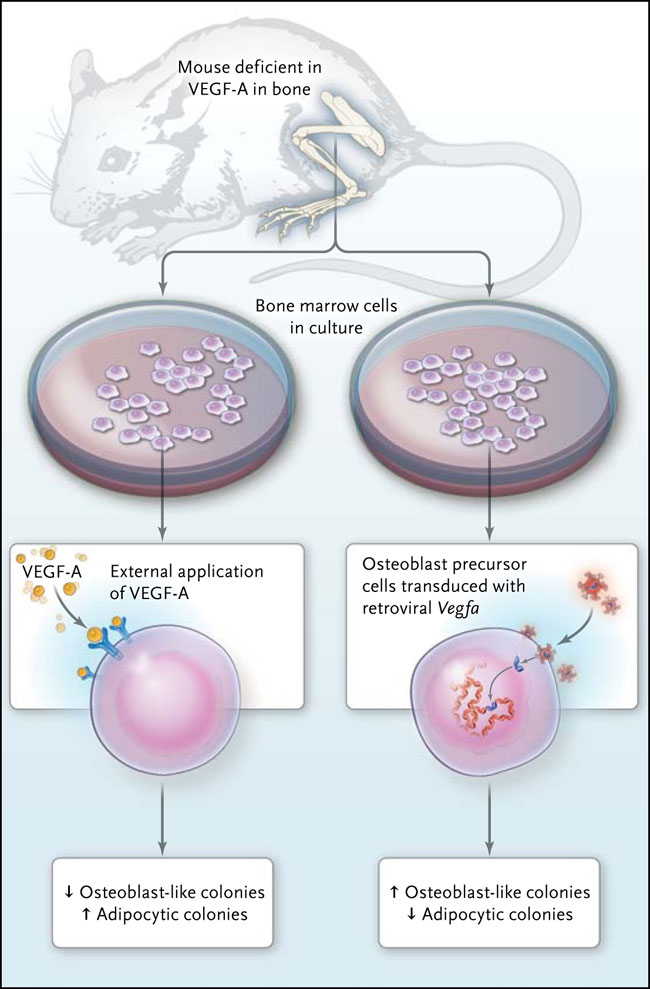
La investigación suprimió el gen VEGF-A en los osteoblastos mediante el cruce de ratones que tenían alelos de VEGFa con ratones que expresaban la recombinasa Cre bajo control del factor de transcripción osterix, requerido para la diferenciación de los osteoblastos; cuando se activa, este sistema selectivamente impide la formación de VEGFa. Se observó un fenotipo tipo osteoporosis que se desarrolla en animales con células precursoras de osteoblastos deficientes en VEGF-A. Cuando se cultivan en un medio apropiado, estas generan menos colonias tipo osteoblastos y más líneas adipocíticas. En contraste, la transducción de células que expresan VEGF-A produce el efecto contrario, se generan más colonias tipo osteoblastos y menos adipocíticas. Por lo tanto, la expresión intracelular de VEGF-A, pero no la aplicación externa del factor de crecimiento, podría corregir el defecto.
Si bien el enfoque sobre el VEGF-A era inusual, tenía precedentes. La mayoría de los investigadores se han centrado en otras vías de señalización, en particular la de la proteína morfogenética ósea (BMP) y de Wnt. Sin embargo, la señalización de VEGF-A también es importante en la biología del hueso. Por ejemplo, la mineralización de los huesos largos durante el desarrollo embrionario (osificación endocondral) comienza con una invasión de los vasos sanguíneos que expresan VEGF-A en modelos cartilaginosos que se sintetizan inicialmente en la forma ósea. Además, VEGF-A se expresa a altos niveles en los precursores de osteoblastos y puede estimular la diferenciación osteogénica en varios tipos celulares. Tal vez lo más intrigante de todo sea la observación que los niveles de VEGF-A en muchas células disminuyen con el envejecimiento. Por lo tanto, el fenotipo de la osteoporosis en ratones mutantes no es por sí mismo una gran sorpresa. Por otra parte, no existen extrañezas en los primeros experimentos que involucraron cultivos celulares de médula ósea de ratones. Como era de esperar, éstas generaron una disminución del número de colonias tipo osteoblastos y un número cada vez mayor de colonias adipocíticas cuando se cultivaron en medios apropiados.
Entonces llegó la gran sorpresa. La adición de VEGF-A a los cultivos de células de médula ósea de ratones no tuvo ningún efecto. Sorprendentemente, sin embargo, transducir las células con un retrovirus capaz de expresar VEGF-A corrigió el defecto. ¿Conclusión? El agotamiento de VEGF-A debe conducir a la osteoporosis por medio de un mecanismo intracelular. Como señalan los autores, un estudio similar ha demostrado la presencia de señalización intracelular de VEGF-A en células madre hematopoyéticas.
Yanqiu Liu y colaboradores realizaron una serie de experimentos con otra línea de ratones transgénicos y cultivos de células óseas para definir el bucle intracelular de VEGF-A de forma más exacta. Sus resultados sugieren que VEGF-A intracelular controla la diferenciación de células madre mesenquimatosas mediante la regulación, en el núcleo, del factor de transcripción 2 relacionado con Runt (RUNX2), un factor de transcripción clave que regula la osteogénesis, y de la peroxisoma proliferador activado del receptor 2 (PPARγ2), un receptor nuclear que controla el almacenamiento de ácidos grasos y el metabolismo de la glucosa. Además, demostraron que el VEGF-A intracelular tiene importantes interacciones con las proteínas lamina A y lamina C de la envoltura nuclear.
¿Consecuencias de estas observaciones? Los resultados de este estudio sugieren que podemos ser fácilmente seducidos por el paradigma de que la diferenciación celular está controlada principalmente por la unión de ligandos a los receptores en la superficie celular. Para VEGF-A, al menos, la situación es más compleja. Durante la diferenciación osteogénica, el mensaje pasa al citoplasma para ser traducido en proteína, la que se mueve hacia el núcleo para regular varios genes que son necesarios a la hora definir el fenotipo de las células. Al volver al núcleo, la proteína también regula los poros que controlan el tráfico entre el núcleo y el citoplasma. En definitiva, este estudio revela una complejidad que necesitará tiempo para develar, sobre todo si otros factores de crecimiento y citoquinas actúan a través de similares bucles intracelulares. Pero los resultados también comienzan a identificar los objetivos de nuevos medicamentos para atraer a las células progenitoras en pacientes con osteoporosis y convertirlas en osteoblastos en lugar de adipocitos.
Fuente bibliográfica
New Targets for Osteoporosis
Darwin J. Prockop, M.D., Ph.D.
Texas A&M Health Science Center College of Medicine Institute for Regenerative Medicine at Scott & White, Temple, Texas.
DOI: 10.1056/NEJMcibr1210178