Mal corazón por culpa de la quimioterapia
El receptor 2 del factor de crecimiento epidérmico humano (también llamado ERBB2) es una glicoproteína transmembrana de 185 kDa con actividad tirosina quinasa. Se cree que es uno de los mediadores importantes del crecimiento celular. Se sobre-expresa en el 25-30% de los cánceres de mama humanos, juega un destacado papel en la patogénesis de la enfermedad y es un marcador predictivo de mal pronóstico en la enfermedad metastásica. Durante los últimos años se han desarrollado nuevas terapias dirigidas a células tumorales mediante el bloqueo de HER-2 en la superficie celular de las células tumorales, inhibiendo así el crecimiento.
El fármaco más utilizado basado en este principio es trastuzumab, ya sea como agente único o en combinación con quimioterapia. Lamentablemente, uno de los principales efectos secundarios observados ha sido su cardiotoxicidad. La insuficiencia cardíaca congestiva relacionada con la terapia puede ser grave y se ha relacionado con síntomas incapacitantes.
ERBB2 e insuficiencia cardíaca
Durante ensayos con medicamentos se han podido descubrir inesperados aspectos relacionados con la biología básica de la función del órgano, que suelen presentar implicaciones de largo alcance. Esta fue la experiencia con trastuzumab, un inhibidor de ERBB2 (conocido como HER2/neu), uno de las cuatro tirosina-quinasa del receptor (EGFR) del factor de crecimiento epidérmico (EGF) o de la familia ERBB. La activación de ERBB2 tiene efecto oncogénico, el gen ERBB2 se amplifica hasta un 30% en los cánceres de mama e indica mal pronóstico. El anticuerpo monoclonal humanizado trastuzumab, cuando se añade a la quimioterapia, o a otras terapias anti-ERBB2, o en ambos casos, se dirige a ERBB2 y mejora la supervivencia en pacientes positivos para ERBB2.
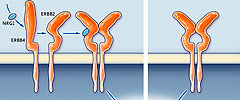
Esta familia de ligandos y receptores se encuentra en múltiples sistemas orgánicos. Investigaciones paralelas en cáncer y biología cardíaca se han cruzado con la observación que el tratamiento con trastuzumab está asociado con la insuficiencia cardíaca congestiva en individuos oncológicos (fig. 1). Este hallazgo ha impulsado el interés en la biología de la señalización de ERBB en el corazón, lo que está siendo analizado como un posible nuevo objetivo terapéutico para la insuficiencia miocárdica.
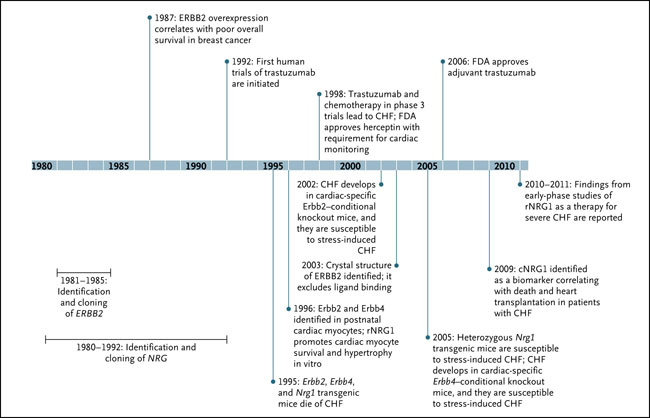
CHF corresponde a insuficiencia cardíaca congestiva, cNRG1 el circulante de NRG1, FDA, la Administración de Medicamentos y Alimentos y rNRG1 el recombinante de NRG1.
Los receptores ERBB y los ligandos (por ejemplo, neuregulina [NRG] y EGF) forman una red estrechamente regulada que controla importantes funciones celulares durante la morfogénesis de los órganos y el mantenimiento de los tejidos en los adultos. Las vías de señalización de ERBB son áreas muy complejas en donde múltiples capas de regulación y bucles de señalización inhiben o estimulan el sistema. En los mamíferos se forman cuatro receptores ERBB (ERBB1 hasta ERBB4) homodímeros o heterodímeros después de la unión del ligando. La dimerización activa los dominios de la tirosina-quinasa, que conduce al reclutamiento de efectores, incluyendo fosfatidilinositol 3-quinasa AKT y la proteína quinasa por mitógenos (fig. 2). Aunque ERBB2 tiene un dominio quinasa intacto, es incapaz de unirse al ligando. Así, ERBB2 amplifica la entrada extracelular a través de la dimerización con otros receptores ERBB unidos al ligando.
Regulación adicional se consigue por el control de la expresión del receptor y por la multiplicidad de ligandos, isoformas de ligandos, y la diferencial de la afinidad del receptor ligando-isoforma. En relación al papel en el cáncer, el desequilibrio en casi cualquier nivel del sistema puede conducir a la oncogénesis, por ejemplo, la señalización constitutiva se produce a través de la amplificación de genes (por ejemplo, ERBB2 en el cáncer de mama), mutaciones puntuales (por ejemplo, en EGFR y en vías descendentes tales como K-ras en muchos tipos de cáncer), y desregulación de la señalización autocrina (por ejemplo, NRG-ERBB3 en el cáncer de ovario).
Los primeros ensayos clínicos establecieron claramente a trastuzumab como terapia anticancerosa eficaz. Sin embargo, un efecto colateral preocupante e inesperado fue la disfunción cardíaca. Añadir el principio a la quimioterapia con antraciclina se asoció con disfunción sistólica cardíaca en el 27% de los pacientes, en comparación con el 8% en los que recibieron quimioterapia sola. En posteriores estudios que no incluyeron antraciclinas y excluyeron a pacientes con enfermedad cardiovascular pre-existente, el riesgo de insuficiencia cardíaca congestiva fue del 3,9% (a pesar que la disfunción cardíaca asintomática se detectó en un 34% de las personas). En la mayoría, pero no en todos, la cardiotoxicidad relacionada a trastuzumab fue reversible. En 1995, cuando el ensayo fase 3 comenzó, ya se sabía que la señalización NRG-ERBB era necesaria para el desarrollo cardíaco. También se había observado el desarrollo de una inesperada insuficiencia por trabeculación ventricular en ratones con inactivación de ErbB2, ErbB4 o Nrg1. Además, los primeros estudios preclínicos del corazón postnatal demostraron la persistente expresión de ERBB2 y ERBB4, sugierendo los datos un papel para estos receptores en la hipertrofia y supervivencia de los miocitos.
La observación clínica de la toxicidad cardíaca asociada a trastuzumab permitió realizar investigación adicional de este sistema en la fisiopatología y el tratamiento de la insuficiencia cardíaca congestiva. Se encontró que el eje NRG-ERBB era un componente crítico en la respuesta de esfuerzo del corazón. En miocitos cardíacos de ratones knockout para ERBB2 y ERBB4, la cardiomiopatía se desarrolló entre las 8 y 12 semanas de vida. Estos animales se adaptaron mal a las presiones, incluyendo a las antraciclinas y la sobrecarga de presión. Además, los ratones knockout heterocigotos (en donde la expresión de NRG1 es baja) presentaron mayor sensibilidad a las antraciclinas. En la arquitectura altamente organizada del miocardio ventricular, los miocitos se rodean por células endoteliales microvasculares coronarias, con una extensa red de control sobre la organización y función tisular. Las células endoteliales coronarias expresan NRG1, el producto del gen que actúa sobre los receptores ERBB en miocitos cardíacos. Otros efectos incluyen la regulación de la arquitectura miofilamentosa, la promoción de la supervivencia celular, el metabolismo de la glucosa, contractilidad y angiogénesis, y la formación y mantenimiento del sistema de conducción.
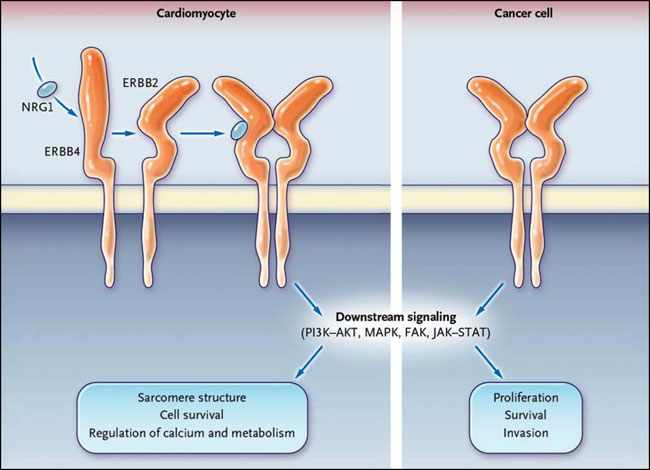
Al lado izquierdo, ERBB2 existe en una conformación ligando determinada en la línea base. NRG1 se une a ERBB4 en el corazón (o a ERBB3 en otros tipos de células). El receptor experimenta un cambio conformacional que permite la dimerización con ERBB2, la fosforilación cruzada, y el reclutamiento de efectores, incluyendo al fosfatidilinositol 3-quinasa AKT (PI3K/AKT), proteína quinasa activateda por mitogenos (MAPK), a la quinasa de adhesión focal (FAK), y las janus quinasa asociadas a la señal de transductores y activadores de transcripción (JAK-STAT). A la derecha, en las células tumorales, la activación de la cascada de señalización de ERBB ocurre a través de múltiples mecanismos, incluyendo, por ejemplo, la amplificación génica de ERBB2 (en el cáncer de mama) y mutaciones puntuales en ErbB1 del receptor del factor de crecimiento epidérmico (en el cáncer de pulmón).
Con la aparición de esta evidencia, los ligandos NRG se están estudiando como biomarcadores y agentes terapéuticos para la insuficiencia cardíaca congestiva. En una serie de 900 pacientes con insuficiencia cardíaca congestiva, los niveles de NRG1 se correlacionaron con la severidad de la enfermedad y el riesgo de muerte o necesidad de trasplante cardíaco. Este hallazgo sugiere que el estrés cardíaco en curso activa la liberación de NRG1 que es análoga a la sobrecarga de presión en modelos animales. Se carece de datos para establecer si las concentraciones de NRG1 representan un biomarcador clínicamente relevante de lesión cardíaca e insuficiencia cardíaca congestiva.
NRG1recombinante (rNRG1) está siendo investigado como una molécula terapéutica en la insuficiencia cardiaca congestiva. En 15 pacientes, una infusión durante 11 días del péptido rNRG1 generó un aumento en el gasto cardíaco, disminución de la presión en la arteria pulmonar e incremento del 12% en la fracción de eyección del ventrículo izquierdo a las 12 semanas. Un segundo ensayo clínico con otra formulación de rNRG1 está actualmente en curso. Preocupación obvia es si los agonistas ERBB podrían estimular el crecimiento del cáncer, habrá que prestar atención a esta posibilidad ya que tales ensayos están en curso.
En resumen, las terapias dirigidas a ERBB2 han mejorado los resultados en pacientes con cáncer de mama y mayor expresión de ERBB2. La inesperada toxicidad cardíaca del anticuerpo monoclonal trastuzumab ha impulsado la comprensión del papel fundamental de ERBB en la homeostasis cardíaca y la respuesta al estrés. Estas respuestas adversas han dado lugar a investigaciones sobre la activación de ERBB para mejorar la insuficiencia cardíaca.
Fuente bibliográfica
ERBB2 Inhibition and Heart Failure
Gregory M. Cote, M.D., Ph.D., Douglas B. Sawyer, M.D., Ph.D., and Bruce A. Chabner, M.D.
Massachusetts General Hospital Cancer Center, Boston (G.M.C., B.A.C.); and Vanderbilt University School of Medicine, Nashville (D.B.S.).
DOI: 10.1056/NEJMcibr1203156