Inflamación y degeneración macular
En los ancianos, la degeneración macular relacionada con la edad representa la primera causa de ceguera en todo el mundo, es un trastorno ocular bilateral que afecta a la zona central de la retina conocida como mácula. La mácula lútea, que deriva su nombre de la deposición de pigmentos amarillos xantofilas, se encuentra en la papila óptica y está limitada por las arcadas vasculares temporales superior e inferior. Aunque la mácula comprende solamente el cuatro por ciento del área de la retina, es finalmente la responsable de la visión fotópica útil.
La DMAE tiene un tremendo impacto en la salud física y mental de la población geriátrica y sus familias. Antes de 1990, todas sus formas se referirían a menudo como "la degeneración macular senil", un reflejo del hecho que la pérdida de visión asociada a la DMAE se manifiesta tarde en la vida cuando la mayoría de las personas están deseando disfrutar de las actividades de retiro e independencia. En cambio, millones de personas con DMAE sufren la pérdida bilateral de la visión central de tal manera que ya no pueden conducir, leer un periódico, preparar las comidas o disfrutar de actividades recreativas. Para muchos pacientes, la deficiencia visual significa una pérdida de la independencia, depresión, aumento de las preocupaciones financieras y la necesidad de adaptarse a la ceguera en un momento en que probablemente sufran de otras condiciones invalidantes.
Aspectos moleculares de la degeneración macular
La degeneración macular relacionada con la edad (DMAE) es la principal causa mundial de pérdida de la visión central. Por lo general, se clasifica de dos formas: una condición seca, caracterizada por la aparición de drusas (fig. 1), que son colecciones proteináceas a nivel del epitelio pigmentario de la retina, y por la atrofia del epitelio pigmentario de la retina, y un forma húmeda, en la que la neovascularización complica los cambios retinales. Al igual que otras enfermedades crónicas y progresivas asociadas con el envejecimiento (por ejemplo, enfermedad de Alzheimer y aterosclerosis), la inflamación contribuye a la patogénesis de la DMAE. El papel de la inflamación se apoya en la detección de productos del sistema inmune en las mismas drusas y por resultados de estudios de asociación genómica que implican a varios componentes de una cascada complementaria en la patogénesis de la enfermedad. Dos publicaciones recientes, una de Sarah L. Doyle y colaboradores (Nat Med 2012; 18:791-8) y otra de Valeria Tarallo y colegas (Cell 2012; 149:847-59), han demostrado que NLRP3, un componente del sistema inmune innato que detecta patrones moleculares de peligro, está implicado en la degeneración macular. Los dos estudios son notablemente similares y diferentes a la vez.
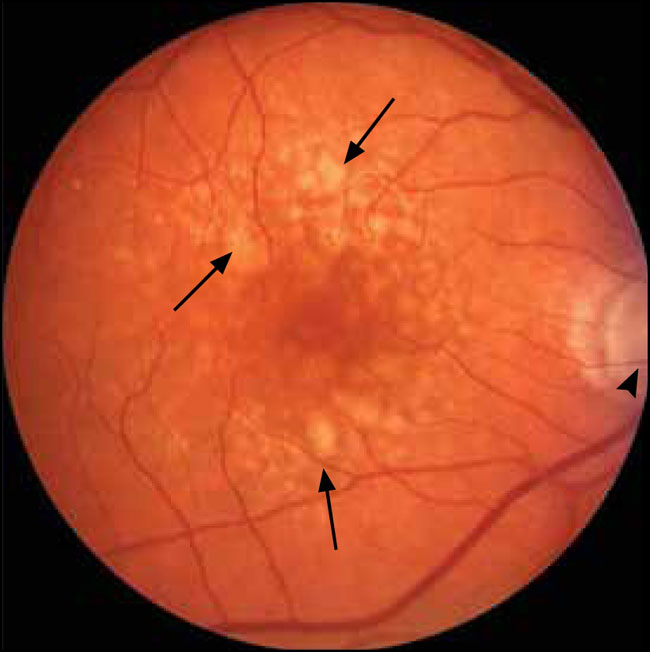
Los depósitos amarillos de forma irregular (flechas) son drusas. Las puntas de las flechas corresponden al nervio óptico. Las drusas son características de las formas húmeda y seca. La neovascularización coroidea, el sello distintivo de la DMAE húmeda, está ausente en esta foto, en consecuencia, representa la DMAE seca.
Las mutaciones en NLRP3 causan enfermedades autoinflamatorias poco comunes denominadas síndromes periódicos asociados a la criopirina. NLRP3 se une con otras dos proteínas citoplasmáticas, ASC y procaspasa 1, para formar un complejo llamado inflamasoma. El inflamasoma, a su vez, activa la enzima caspasa 1, que pasa a activar varias proteínas intracelulares, incluyendo la interleuquina-1β y la interleucina-18. Los conocimientos obtenidos a partir de estudios con la criopirina han dilucidado la función de NLRP3 y contribuido a comprender que enfermedades relativamente comunes, como la gota y la seudogota, también están mediadas por la inflamasoma.
El grupo de S. Doyle encontró que las drusas se estimulan por NLRP3 (fig. 2). La activación también es inducida por el componente del complemento C1Q o por el carboximetilpirrol, una proteína modificada por el estrés oxidativo. Tarallo y colegas igualmente observaron que en estudios de ratón y en cultivo de tejidos, NLRP3 se activa en pacientes con degeneración macular, pero este grupo utilizó un ARN motivo conocido por una repetición Alu que acciona el inflamasoma. Ellos previamente habían informado el efecto de las repeticiones Alu en la patogénesis de la DMAE. Juntos, los dos equipos de investigación han ampliado la lista de posibles desencadenantes de la caspasa 1 - una serie que ya incluye diversos productos químicos como el ácido úrico y el hidróxido de aluminio.
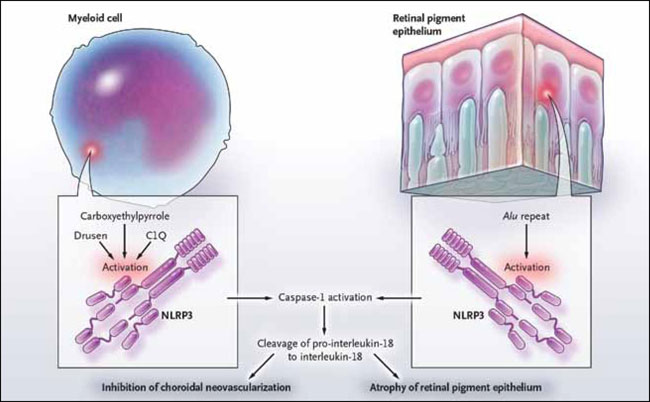
Dos estudios recientemente han implicado a NLRP3, un componente del inflamasoma, en la degeneración macular relacionada con la edad. Uno de estos sugirió que NLRP3, que se expresa en células mieloides, inhibe la neovascularización coroidea y protege así contra la enfermedad. El otro, concluye que la activación de NLRP3 en el epitelio pigmentario de la retina conduce a la atrofia de esta estructura. Los factores locales que activan a NLRP3 incluyen a las drusas, C1Q, repeticiones Alu, y el carboximetilpirrol. El NLRP3 activado estimula la caspasa-1, la cual acciona la interleucina-18, lo que a su vez interrumpe la neovascularización coroidea o destruye el epitelio pigmentario de la retina.
En la mayoría de los casos en los que se activa el inflamasoma, la interleucina-1 se convierte en el principal "protagonista". Por ejemplo, las enfermedades hereditarias causadas por mutaciones en NLRP3 eran casi intratables hasta hace poco, pero ahora se sabe que responden al bloqueo de la interleucina-1. Sorprendentemente, por lo tanto, ambos grupos llegaron a la conclusión que la principal consecuencia de la activación del inflamasoma en la retina es la producción de interleucina-18. El trabajo de S. Doyle señala que la fuente de esta citoquina probablemente sean las células mieloides. Aunque NLRP3 se expresa predominantemente en derivados de células de médula ósea, la investigación de Tarallo y colaboradores sostiene que el epitelio pigmentario de la retina es principalmente responsable de la interleucina-18 (las interleucinas, de las cuales hay más de 36, son citocinas que son denominadas así por su papel en la comunicación entre los leucocitos, pero su expresión no se limita sólo a los leucocitos).
Los dos grupos llegaron a conclusiones opuestas sobre la consecuencia de la interleucina-18 en la DMAE. Tarallo y colegas encontraron que la interleuquina-18 promueve el daño al epitelio pigmentario de la retina en un modelo de ratón que imita los aspectos de la forma seca. A su vez, el grupo de S. Doyle utilizó un modelo de ratón para la neovascularización coroidea, el sello distintivo de la DMAE húmeda, y concluyó que la interleuquina-18 inhibe la formación de nuevos vasos, en donde la atrofia del epitelio pigmentario de la retina no fue lo más predominante.
Así, un grupo concluye que la inflamación es perjudicial y el otro que la inflamación es beneficiosa. Es posible que ambos grupos estén en lo correcto y que la interleuquina-18 tenga una doble función en la DMAE. Si es así, la interleucina-18 como agente terapéutico representaría un dilema faustiano, ya que su aplicación podría tener una acción favorable (es decir, el bloqueo de la neovascularización) y una desfavorable (la destrucción del epitelio pigmentario de la retina) en la porción posterior del ojo. La inhibición de la interleucina-18 podría salvar el epitelio pigmentario de la retina, promoviendo el crecimiento de nuevos vasos. A medida que la biología se clarifica, probablemente surjan nuevos objetivos para la interleucina-18.
Fuente bibliográfica
Eyeing Macular Degeneration — A Few Inflammatory Remarks
James T. Rosenbaum, M.D.
Departments of Ophthalmology, Medicine, and Cell Biology, Oregon Health and Science University, Portland.
N Engl J Med 2012; 367:768-770