Restricción calórica para el cáncer
Una reducción del 20 al 40% en el consumo de calorías o restricción calórica (RC) protege a una amplia variedad de organismos contra el estrés oxidativo y el envejecimiento. Debido a esta capacidad, la RC podría en teoría ser aplicada en la clínica para proteger a los pacientes de los tóxicos efectos secundarios de la quimioterapia. Sin embargo, no es viable para individuos propensos a la pérdida de peso por el cáncer en sí mismo o por la quimioterapia, debido a que, basándose en estudios con animales, se necesitan varios meses de RC para alcanzar un estado de protección.
Así, además de requerir grandes cambios de estilo de vida, el ayuno inevitablemente causa una pérdida de peso crónica. Además, sólo retarda la progresión de algunos cánceres específicos, posiblemente debido a su efecto relativamente pequeño sobre la glucosa y los factores de crecimiento. En los seres humanos, no reduce la caída del factor de crecimiento semejante a la insulina tipo I (IGF-I) a menos que se combine con la restricción de proteínas. Finalmente, no se sabe si la restricción calórica también podría proteger a las células cancerosas de la quimioterapia.
Toxicidad en la quimioterapia
La comida es un potente inductor de la respuesta metabólica. Algunos nutrientes mejoran el desarrollo muscular, mientras que otros modulan la respuesta inflamatoria o el mismo apetito. Por otro lado, se sabe que la restricción calórica en condiciones normales (es decir, la ingesta prolongada de calorías 20 a 40% menos de lo requerido) protege contra la aparición de enfermedades crónicas. La consideración de los efectos diferenciales de los alimentos y su ausencia en las vías metabólicas durante la enfermedad pueden ser una estrategia capaz de optimizar la eficacia de los tratamientos farmacológicos.
Mejoras significativas en el campo de la oncología permiten una mejor prevención, detección, diagnóstico precoz y tratamiento. No obstante, la prevalencia de cáncer sigue siendo alta, como los costos del tratamiento y la mayoría de los cánceres aún no tienen cura. La posibilidad que la respuesta del paciente a la terapia contra el cáncer pueda ser optimizada a través de cambios en la dieta es un aspecto atractivo, ya que probablemente sea asequible y de fácil acceso.
Las células normales y cancerosas difieren en su capacidad para responder al ayuno. En ausencia de nutrientes, las primeras cambian su metabolismo hacia vías de mantenimiento, mientras que las segundas son incapaces de activar esta respuesta protectora. Las diferencias metabólicas entre células normales y cancerosas se podrían utilizar para mejorar selectivamente la terapia contra el cáncer con una mayor resistencia de las células normales a la quimioterapia, es decir, mediante un incremento diferencial de la resistencia en lugar del desarrollo de fármacos más agresivos y tóxicos (fig. 1). Changhan Lee y colaboradores (Sci Transl Med 2012; 4:124ra27) describieron recientemente información que apoya este enfoque. Encontraron que el hambre a corto plazo aumenta la sensibilidad de las células de levadura que expresan una forma activa del oncogén al estrés oxidativo, y por tanto a la quimioterapia, en comparación con su efecto sobre las células de levadura tipo salvaje. Además, encontraron que la restricción de la glucosa y los factores de crecimiento en medio de cultivo durante 24 horas antes y 24 horas después del tratamiento con doxorrubicina y ciclofosfamida generó 15 (de 17) líneas celulares más sensibles a estos fármacos.
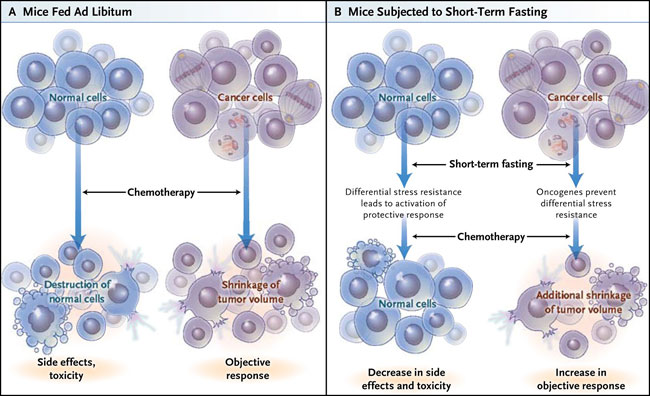
El estrés oxidativo inducido por la quimioterapia reduce las tasas de proliferación y supervivencia de las células cancerosas. Se produce una respuesta objetiva que se cuantifica sobre la base de la contracción del volumen tumoral (panel A). Sin embargo, la quimioterapia también afecta a las células normales, lo que provoca efectos secundarios tóxicos. Se sabe que ciclos cortos de ayuno, antes o después de la quimioterapia, o en ambos momentos, inducen la resistencia al estrés diferencial en células normales y cancerosas. En células normales, el ayuno activa las vías metabólicas de protección que confieren resistencia al estrés oxidativo (panel B). En contraste, las levaduras con un oncogén activado son incapaces de motivar respuesta protectora y, por tanto siguen siendo sensibles al estrés oxidativo. Los experimentos adicionales que han utilizado modelos de ratón para el cáncer humano han demostrado que el ayuno aumenta específicamente los niveles de estrés oxidativo y la sensibilidad al daño oxidativo (por ejemplo, los infligidos por los agentes de quimioterapia) en las células cancerosas y que estos efectos son acompañados por daño al ADN y apoptosis.
Para confirmar estos efectos in vivo, el grupo de C. Lee estudió ratones con aloinjertos subcutáneos de cánceres murinos o xenoinjertos de células cancerosas humanas. Se observó que 48 a 60 horas de privación de alimentos retrasa el crecimiento tumoral, que en algunos casos representa la forma más eficaz de quimioterapia, registrándose una sinergia entre el hambre y la terapia farmacológica. Luego, para investigar los efectos del hambre a corto plazo en el cáncer metastásico avanzado, se estudiaron ratones con melanoma, neuroblastoma o células de cáncer de mama, en donde encontraron que el ayuno potenció los efectos de la quimioterapia y mayor supervivencia en estos animales. También investigaron los mecanismos moleculares que subyacen a estos efectos biológicos, aunque sólo en los aloinjertos de cáncer de mama. Después del ayuno, la proliferación de genes asociados se regula hacia la baja en los tejidos normales, pero estuvieron sobre-regulados o no afectados en las células cancerosas. Además, las concentraciones de Akt y S6K fosforiladas estaban elevadas en las unidades cancerosas de animales que habían ayunado, encontrándose que los niveles de estrés oxidativo y de sensibilización al daño oxidativo (un efecto primario de la quimioterapia en las células cancerosas) se incrementaban.
Es tentador unir estos interesantes resultados en el actual enfoque integral de los pacientes con cáncer. Pero esta acción sería prematura. Durante el período de realimentación después de un ayuno, varios de los cánceres experimentales volvieron a un tamaño similar a los de los animales control. El uso de la restricción calórica, en contraposición al corto plazo, no es recomendado en pacientes con cáncer que son propensos a la desnutrición o a los efectos secundarios de las terapias anticancerígenas. En todo caso, los estudios en animales sugieren que la restricción calórica podría llevar meses para lograr una respuesta antitumoral en los seres humanos. La desnutrición inevitablemente, lleva al aumento de morbilidad y mortalidad.
Los ensayos clínicos podrían ser considerados como una forma de probar los efectos del ayuno o de la restricción de nutrientes específicos de 2 ó 3 días durante y después de la quimioterapia. Con respecto a los cuidados paliativos, los resultados preliminares sugieren que la integración de la resistencia diferencial puede mejorar la respuesta de los pacientes y el cumplimiento de las terapias contra el cáncer. En una serie de casos de 10 pacientes con cáncer sometidos a ayuno de manera voluntaria a corto plazo, antes o después de la quimioterapia (o en ambos momentos), se redujeron los efectos de la fatiga, la debilidad y los efectos secundarios gastrointestinales. Los ensayos clínicos actualmente en marcha están siendo realizados para probar el impacto a corto plazo del ayuno en la quimioterapia asociada a toxicidad. A pesar de la fuerte evidencia, aún no se ha obtenido apoyo para el uso de la resistencia diferencial como medio de ayuno para mejorar la respuesta a la quimioterapia, pero posiblemente ésta no tardará en llegar.
Fuente bibliográfica
Toxicity in Chemotherapy — When Less Is More
Alessandro Laviano, M.D., and Filippo Rossi Fanelli, M.D.