Tu inmunidad es lo que comes
Las superficies de las mucosas, especialmente en el intestino, son las vías de entrada más frecuentes para los agentes patógenos. El tracto gastrointestinal puede verse como una invaginación del medio ambiente en el cuerpo del huésped. La mucosa intestinal es de hecho la mayor interfaz con el mundo exterior. Tiene dos funciones principales: (i) ser barrera para los estímulos externos nocivos y (ii) representar un activo sitio de intercambio. Dado que las moléculas tienen que pasar a través del epitelio de la mucosa, esta área carece de la protección mecánica que el epitelio multicapa y queratinizado de la piel puede proporcionar, lo que podría explicar la acumulación de una gran variedad de mecanismos defensivos no específicos en el intestino, así como la acumulación de un elevado número de células inmunológicamente reactivas. El sistema local inmune intestinal es capaz de una defensa rápida y poderosa contra la invasión de organismos, además de suprimir respuestas contra material antigénico no invasivo con tal de evitar reacciones potencialmente perjudiciales para estos antígenos. Por lo tanto, la superficie de la mucosa intestinal debe mantener un equilibrio aparentemente precario entre la relajación, el peligro de enfermedad y el propio daño por autoinmunidad.
Por otra parte, el equilibrio nutricional es esencial para el desarrollo del sistema inmune en células y órganos. Nutrientes específicos también parecen actuar como cofactores críticos en la expresión de la respuesta inmunológica. Además, los microbios afectan directamente a la digestión y actúan como proveedores de nutrientes en el tracto gastrointestinal, relaciones que están estrechamente vinculadas entre sí de manera interactiva a través de la función del sistema inmune intestinal.
Dieta e inmunidad intestinal
"Eres lo que comes". Recientes estudios ponen de relieve la importancia de este adagio para el sistema inmunológico. Los ensayos de Elina A. Kiss y colaboradores (Science. 2011 Dec 16; 334(6062):1561-5) y Ying Li y colegas (Cell 2011; 147:629-40) demuestran cómo ciertos componentes derivados de vegetales interactúan con receptores inmunológicos intestinales y son capaces de regular la organogénesis de los folículos linfoides, la inmunidad intestinal y la microbiota. Las dietas occidentales son consideradas factores de riesgo para algunas enfermedades, especialmente la enfermedad intestinal inflamatoria (EII). El alto consumo de vegetales protege de la colitis ulcerosa, mientras que una dieta rica en ciertas grasas, ácidos grasos poliinsaturados y la carne aumentaría el riesgo de la enfermedad de Crohn y colitis ulcerosa. En consecuencia, es posible que los componentes de la alimentación puedan prevenir o inducir la inflamación en el tracto gastrointestinal.
El receptor de aril hidrocarburos (AhR) es un factor de transcripción activado por ligandos presente ampliamente en las células de vertebrados. Los ligandos de Ahr se originan básicamente del ambiente, e incluyen dioxinas y compuestos químicos naturales, como los derivados del triptófano, metabolitos bacterianos y fitoquímicos (por ejemplo, los polifenoles y glucosinolatos). La activación de Ahr se produce después de la participación de ciertos ligandos Ahr generando su translocación en el núcleo, donde se une a su socio de dimerización, el translocador AhR nuclear (Arnt) (fig. 1). El heterodímero se une y activa muchos genes con funciones en la inmunidad y la inflamación. Ambas investigaciones mostraron que los componentes específicos de vegetales crucíferos de la familia Brassicaceae (por ejemplo, brócoli, repollo y coles de bruselas) son ligandos fisiológicos de AhR, manipulando de ese modo el sistema inmune del huésped. E. Kiss y colegas observaron que la activación de Ahr por estos ligandos es fundamental para la expansión postnatal de ciertas células linfoides innatas y la de folículos linfoides intestinales. Los ratones deficientes en AhR tienen una respuesta inmune disminuida y son altamente susceptibles a la infección por Citrobacter rodentium. El grupo de Y. Li observó que Ahr es fundamental para el mantenimiento de los linfocitos intraepiteliales, células que intervienen en la inmunidad local y la defensa. También, la deficiencia de Ahr da lugar a una mayor vulnerabilidad epitelial, a activación inmune y composición alterada de la microbiota.
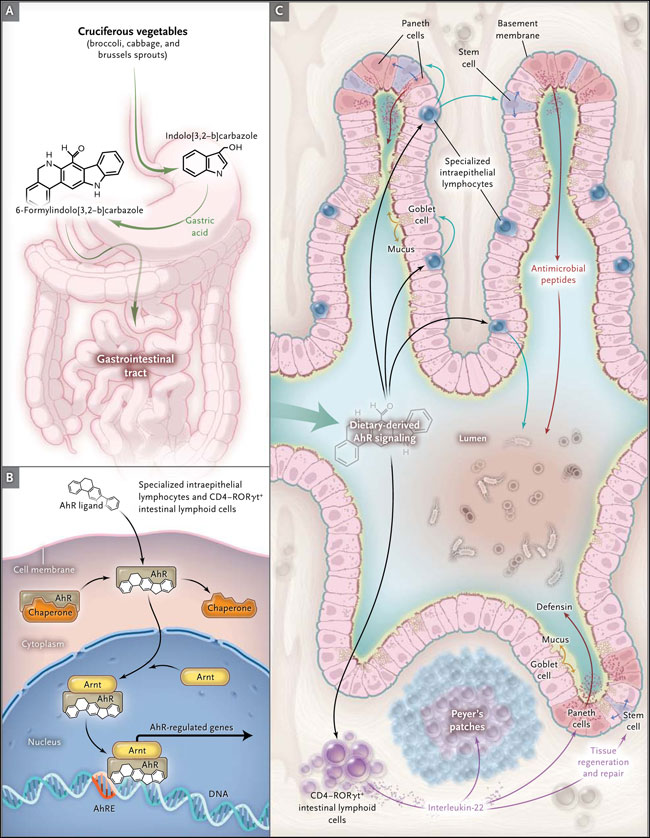
Las funciones inmunes intestinales dependen de ligandos AhR. El indol-3-carbinol es un ligando Ahr que se encuentra en las verduras crucíferas, como el brócoli y las coles de bruselas. Después de su consumo por vía oral, éste se convierte en presencia de ácido gástrico en ligandos de alta afinidad en indol [3,2-b] carbazol o 6 formilindol-[3,2-b] carbazol (panel A). Los ligandos Ahr activan chaperonas AhRs que se dimerizan con el translocador nuclear de AhR (Arnt), regulando la expresión génica (panel B). Los presente estudios observaron que existen dos tipos de células críticamente dependientes de señales Ahr que derivan de una dieta: los linfocitos intraepiteliales especializados (por ejemplo, el receptor intraepitelial de células T) y las células CD4-RORγt+ intestinal linfoides, ambas capaces de inducir la función en los tejidos (por ejemplo, en placas de Peyer) (panel C). Los ratones que carecen de señales Ahr (obtenidos genéticamente, o mediante la privación alimentaria) no tienen linfocitos intraepiteliales especializados ni células linfoides intestinales, disminuyendo la rotación del epitelio, reduciendo la expresión de péptidos antimicrobianos, microbiota alterada y una mayor susceptibilidad a la inflamación intestinal (inducida por el sulfato de sodio de dextrano o en respuesta a la infección por Citrobacter rodentium) (panel C). La patogénesis de la mayor inflamación en ratones mutantes no se ha dilucidado por completo, y probablemente se deba a la producción defectuosa de interleuquina-22 (citoquina que controla la homeostasis intestinal y protege contra patógenos intestinales).
La interacción de ciertos productos bacterianos con células epiteliales intestinales a través de los llamados receptores de reconocimiento de patrones, tales como los tipo toll, se ha desarrollado como una vía importante para las bacterias y la interacción de los virus con el huésped. Estos dos análisis abren la posibilidad que los receptores de reconocimiento para el patrón de la dieta unan la dieta con la inmunidad intestinal. También sugieren que los ligandos Ahr pueden ejercer beneficios para la salud, en la prevención de enfermedades (por ejemplo, en personas con riesgo de EII) y el tratamiento (por ejemplo, de la enfermedad inflamatoria intestinal, síndrome metabólico y otras patologías). AhR es regulado en el tejido intestinal de las personas con EII, y la activación de su señalización por agonistas específicos inhibe la inflamación y la colitis en el tracto gastrointestinal de ratones. El tratamiento de ratones con un antagonista del receptor AhR provoca enfermedad más grave en los modelos animales de colitis. Los efectos beneficiosos de los ligandos Ahr son conocidos por estar asociados con un aumento en los niveles de interleucina-22, una citoquina que apoya la integridad intestinal, y la producción de moco y defensinas (una clase de péptidos antimicrobianos). Esta observación es consistente con el hallazgo de E. Kiss, es decir, que las células RORγt+ linfoides del intestino, que producen interleucina-22, están obligadas a mantener la expresión de determinados genes epiteliales antimicrobianos. Por lo tanto, parece que los factores dietéticos al unirse con Ahr no afectarían sólo la expresión de citoquinas, sino también la síntesis de las defensinas y otros péptidos antimicrobianos, lo que influye en la composición microbiana.
Varias preguntas surgen de estos estudios. ¿Son necesarias las señales Ahr para el mantenimiento post-natal o la ampliación de células RORγt+ linfoides intestinales? Si es así, ¿qué sucede en caso de hambre, en la que la que no hay una unión con ligandos fisiológicos Ahr dietéticos durante un largo período? Puede esto afectar la integridad del epitelio intestinal y promover la inflamación y susceptibilidad a la infección? ¿Cómo podría afectar a ciertas dietas la expresión de Ahr y la inmunidad local? ¿Existen otros receptores de reconocimiento de patrones dietéticos? ¿Existiría una "dieta inflamatoria" y, de ser así, ¿cómo podría interferir con el sistema inmunológico? Otra opción es la sugerencia que la unión con Ahr es perjudicial en el contexto de la progresión del cáncer. El metabolito quinurenina triptófano, un ligando Ahr endógeno, producido por células cancerosas es capaz de suprimir la respuesta inmune antitumoral.
Todos los puntos propuestos por estos autores, al proporcionar un enlace convincente entre la dieta y las funciones inmunes de protección, han abierto una nueva línea de investigación. Por lo tanto, ha comenzado la búsqueda de alimentos con compuestos similares a los inmunomoduladores.
Fuente bibliográfica
Diet and Intestinal Immunity
Herbert Tilg, M.D.
Christian Doppler Research Laboratory for Gut Inflammation, Medical University Innsbruck, Innsbruck, and Academic Teaching Hospital, Hall in Tirol — both in Austria
N Engl J Med 2012; 366(2):181-183