Células madre y diabetes
El trasplante autólogo de células madre hematopoyéticas es eficaz en el manejo de muchos tumores malignos linfo-hematopoyéticos, incluyendo el linfoma de Hodgkin, el linfoma no Hodgkin y el mieloma múltiple. El procedimiento requiere la recogida previa de un número suficiente de células madre hematopoyéticas, capaces de producir rápidamente células maduras hematológicas. La adquisición de estas unidades puede ser particularmente difícil en pacientes que han sido tratados con terapias tóxicas a las células madre, sobre todo en personas de edad avanzada.
Existen varias técnicas de movilización utilizadas ampliamente que pueden mejorar la movilización de células hematopoyéticas para hacer trasplantes autólogos, pero los métodos para cada paciente dependen de su situación clínica específica. Más del 20% de ellos no logra una adecuada movilización y suelen requerir numerosas aferesis para lograr un rendimiento celular que no retrase la recuperación hematopoyética.
Movilización de células madre hematopoyéticas
El trasplante de células madre hematopoyéticas (CMH) sigue siendo el tratamiento curativo para los pacientes con cánceres hematológicos. El trasplante autólogo o alogénico de células madre requiere la adquisición de un número suficiente de CMH para asegurar un injerto rápido y coherente, minimizando los períodos de pancitopenia tras el trasplante. Se pueden aplicar métodos para optimizar la marginalización de las CMH y aumentar su número para el trasplante. Estos sistemas se basan en el uso de citoquinas (el factor estimulante de colonias de granulocitos [G-CSF] o el factor estimulador de colonias de granulocitos y macrófagos [GM-CSF]) o de citoquinas más quimioterapia, y así inducir la salida efectiva de las CMH de la médula ósea a la sangre periférica, donde pueden ser recogidas por medio de la aféresis. Las CMH expresan CD34, por lo tanto pueden ser capturadas y medidas por medio de citometría de flujo.
Los G-CSF y GM-CSF han sido aprobados por la FDA (Food and Drug Administration) para la movilización autóloga y alogénica de células madre, pero la administración de estas citoquinas con o sin quimioterapia puede dar lugar a la falta de movilización de un número suficiente de células para el trasplante de células madre. La carencia de movilización ("mobilopatía") no sólo tiene un costo adicional, sino también un aumento de morbilidad e incluso de pérdida del trasplante como opción curativa para algunos pacientes. Recientemente, el plerixafor (también llamado AMD3100), una pequeña molécula antagonista del receptor de quimiocina para el eje (CXCR4)-CXC quimiocina ligando 12 (CXCL12), ha sido aprobado para la movilización de células madre, reduciendo moderadamente las tasas de fracaso cuando se combina con G-CSF en pacientes con mieloma y linfoma (CXCL12 es uno de los ligandos de CXCR4, y el eje CXCR4-CXCL12 es una traba fundamental que mantiene a las CMH en la médula ósea y también guía su recalada en este tejido).
Existe una variación considerable en la capacidad de las células madre de pacientes y de donantes sanos para movilizarse. Las causas del fracaso de movilización siguen siendo desconocidas, aunque se asocia con la edad avanzada, sexo femenino, exposición a los agentes quimioterapéuticos que son tóxicos para la médula ósea, a la concentración por milímetro cúbico de sangre antes de la movilización de células CD34 y plaquetas, y a las variantes genéticas de CXCL12. La comprensión de los mecanismos implicados en la movilización de las CMH y las fuerzas dinámicas que definen el nicho se ha expandido fuertemente en la última década. Este lugar puede ser una dicotomía en compartimentos vasculares y el endostio (figura 1). El nicho endostio o osteoblástico está definido por las CMH quiescentes, osteoblastos que expresan CXCL12 y la adhesión de la molécula 1 de adhesión celular vascular y N-cadherina, soportando a los macrófagos CD68+ (que liberan proteasas), citoquinas y proteínas de matriz extracelular.
Los datos recientes sugieren que el G-CSF regula la pérdida de osteoblastos positivos para CXCL12 y disminuye la regulación de CXCL12 abundantes en células reticulares y mesenquimales. Éstas, se encuentran dispersas a lo largo de la médula, pero sobre todo se localizan junto a los sinusoides vasculares y están inervadas directa e indirectamente por nervios simpáticos β-adrenérgicos. El G-CSF induce la movilización de las CMH de los nichos del endostio y vascular a través de sus efectos directos sobre los macrófagos y algunos nervios simpáticos β-adrenérgicos, generando la pérdida de osteoblastos y una dramática desregulación de CXCL12 en los osteoblastos nestina positivos y en los que quedan, abundando en células reticulares. G-CSF también estimula la liberación de proteasas que cortan las múltiples uniones (como CXCL12-CXCR4) que sujetan la CMH en estos nichos. La mayoría de las CMH se encuentran en células reticulares que pueden, posiblemente a través de la interacción con CXCL12, mantener la estabilidad y características de las CMH.
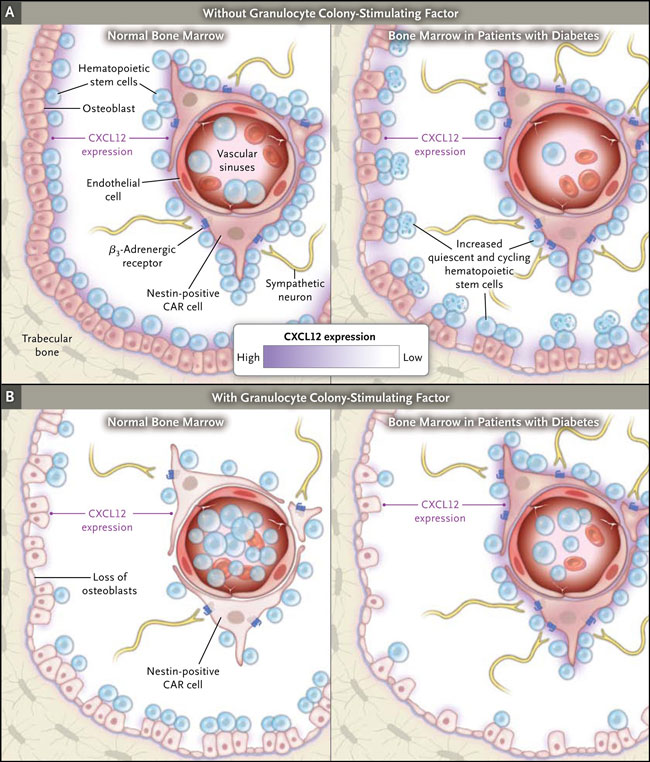
El nicho de la médula ósea se compone de dos elementos principales. El primero son los osteoblastos, los cuales expresan niveles moderados de CXCL12 (rosa) y se unen a las células madre hematopoyéticas (círculos azules) en reposo. El segundo elemento es el nicho vascular, que se compone de senos vasculares, células endoteliales; nestina, abundantes células reticulares (CAR) CXCL12 positivas; receptores β3-adrenérgicos expresados en células CAR; neuronas simpáticas y muchas células madre hematopoyéticas. Como se muestra en el panel A, el microambiente de la médula ósea en pacientes con diabetes tiene un mayor número células madre hematopoyéticas en reposo (círculos azules) y células madre hematopoyéticas en ciclo (formas unidas en azul), menor número de osteoblastos y un aumento de neuronas simpáticas y de receptores β3-adrenérgicos. Como se muestra en el panel B, los granulocitos y el factor estimulante de colonias reducen los osteoblastos y la expresión de CXCL12, tanto en osteoblastos como en células CAR, que resulta en la transmigración de las células madre hematopoyéticas en senos vasculares (circulación periférica). El factor estimulante de colonias de granulocitos induce la reducción de los osteoblastos y la expresión de CXCL12 en los osteoblastos (blanco) pero no de CXCL12 expresión (rojo) en la médula de los diabéticos, en comparación con la médula ósea normal, disminuyendo la transmigración y la movilización de las células madre hematopoyéticas asociadas a las células CAR en los senos vasculares (circulación periférica).
Francesca Ferraro y colaboradores (Sci Transl Med 2011;3:104ra101-104ra101) informaron recientemente que la diabetes es una enfermedad que interrumpe la anatomía dinámica del nicho e induce el microambiente de la médula ósea. Demostraron por primera vez, en una pequeña cohorte de pacientes sometidos a trasplante autólogo, que niveles elevados de glucosa y hemoglobina glicosilada son más comunes en pacientes en los que las CMH no pueden movilizarse en sangre periférica. Se observó un deterioro de la movilización de CMH en ratones diabéticos. Aunque el número total y porcentajes de CMH en la médula ósea de ratones tratados con estreptozotocina fueron elevados en comparación con los de los ratones no tratados, no hubo elevación proporcional en los niveles circulantes de CMH lo que sugiere un defecto en el tráfico de CMH en la médula ósea en reposo. La preferencia de las CMH de la médula ósea en ratones con diabetes se perdió cuando fueron transplantadas a ratones sanos, demostrando que el defecto no fue intrínsecamente vía CMH, sino más bien a la alteración del microambiente de la médula ósea en los ratones con diabetes.
De acuerdo con estos resultados se observó que CMH normales se alojan en la médula ósea de forma más rápida y proliferan (en la médula) con más fuerza cuando se inyectan en ratones con diabetes, en comparación a ratones sanos. El tratamiento de animales sanos con G-CSF produjo la pérdida esperada de osteoblastos y la expresión de CXCL12 en osteoblastos nestina positivos y células reticulares positivas para CXCL12, en consonancia con la movilización vigorosa de CMH. En contraste, el tratamiento de ratones diabéticos con G-CSF dio lugar a una pérdida esperada de osteoblastos y la baja regulación de CXCL12 expresado por los osteoblastos, pero ningún cambio en la expresión de CXCL12 positivo para nestina, células reticulares positivas para CXCL12, gatillando una dramática reducción en la movilización de CMH mediado por G-CSF (figura 1B).
Los defectos en la movilización de CMH después del tratamiento de ratones con agonistas de receptores β3-adrenérgicos, así como los estudios que demuestran que el empobrecimiento genético de los osteoblastos en ratones con diabetes resulta en la eliminación completa de cualquier movilización residual inducida por G-CSF, apoyan la hipótesis de los autores: las alteraciones en G-CSF que inducen la movilización en ratones diabéticos se debe a un defecto en la activación del sistema nervioso simpático (a pesar de un mayor número de fibras nerviosas simpáticas en la médula ósea de ratones con diabetes). Este defecto provoca un bloqueo funcional de G-CSF inducido por la baja regulación de CXCL12 positivo para nestina, células reticulares CXCL12-positivas, y más células residentes que expresan CXCL12 en el nicho vascular. Los autores sugieren que este defecto podría ser superado con el uso de plerixafor con o sin G-CSF. Como plerixafor es un agente de movilización más débil que G-CSF, es posible, pero poco probable, que pueda mediar en el éxito de la movilización de células madre en los diabéticos en el que las células madre no se movilizan después de la administración de G-CSF. Sólo futuros ensayos clínicos prospectivos podrán responder esta pregunta.
El uso de métodos alternativos y una óptima movilización (G-CSF más plerixafor o G-CSF y quimioterapia) podrían ser utilizados como un tratamiento precoz en pacientes con diabetes para limitar las probabilidades de fracaso de la movilización y el número de pacientes que requieran segundas movilizaciones o trasplante alogénico de células madre dentro de una terapia potencialmente curativa.
Fuente bibliográfica
Diabetic Stem-Cell “Mobilopathy”
John F. DiPersio, M.D., Ph.D.
Division of Oncology, Washington University School of Medicine, St. Louis.
N Engl J Med 2011; 365:2536-2538