Infección, importante problema del accidente cerebrovascular
Una de las principales causas de muerte por accidente cerebrovascular es la infección. Se ha propuesto a la inmunosupresión, quizás debido a un cambio sistémico de células citoquinas T ayudantes tipo 1 (Th1) a células T ayudantes tipo 2 (Th2), como una respuesta compensatoria para proteger el cerebro post-isquémico de la abrumadora inflamación. Esta activación excesiva de las vías inhibitorias aumenta la susceptibilidad a las infecciones, aunque el conocimiento del mecanismo subyacente se ha mantenido esquivo hasta la fecha.
Suprimiendo la inmunosupresión después del accidente cerebrovascular
La neumonía es una causa importante de muerte después de la isquemia cerebral aguda. Un reciente estudio de Connie H. Wong y colegas (Science 2011; 334:101-5) ayuda a comprender mejor la susceptibilidad a la infección posterior a un accidente cerebrovascular. En concreto, los autores concluyeron que las infecciones después del accidente cerebrovascular son promovidas por una disfunción noradrenérgica de un pequeño subgrupo de linfocitos: las células T asesinas naturales invariantes.
Más del 40% de los pacientes mueren dentro de un par de semanas después del accidente cerebrovascular o tienen graves discapacidades a largo plazo. Aunque dos tercios de estos resultados se atribuyen a factores no modificables, como la gravedad inicial y la edad, el tercio restante es consecuencia de factores modificables (por ejemplo, complicaciones a tiempo), como el aumento de la presión intracerebral y la infección. A pesar de la atención prolongada en las unidades especializadas, la neumonía bacteriana sigue siendo la complicación médica más importante después del accidente cerebrovascular, lo que representa casi el 20% de las muertes hospitalarias y la causa de los malos resultados después del alta. Esta elevada incidencia se explica por la disfagia, alteración de los reflejos protectores, disminución de la consciencia y estado de postración del paciente - factores que facilitan la aspiración. Aunque la aspiración incrementa claramente el riesgo de neumonía, parece insuficiente que sea responsable de todos los malos pronósticos de la enfermedad.
Hay evidencia creciente que la lesión aguda del sistema nervioso central, incluido el accidente cerebrovascular, perjudica directamente la defensa antibacterial del huésped. La isquemia cerebral focal inducida por la oclusión de la arteria cerebral media se asocia con el desarrollo espontáneo de infecciones bacterianas dentro de las 24 horas después del accidente cerebrovascular, lo que lleva a una alta mortalidad. Las infecciones son precedidas por una rápida supresión de la respuesta celular inmune periférica, que se caracteriza principalmente por apoptosis de los linfocitos y la alteración de la producción de citoquinas linfocíticas, provocada por una sobre-activación del sistema nervioso simpático. Los hallazgos clínicos coinciden con la manifiesta discapacidad de la inmunidad celular antes de la aparición de infecciones en pacientes que han sufrido un derrame cerebral, apoyando la idea que la inmunosupresión inducida por una hemorragia cerebral conduce a complicaciones infecciosas post-isquémicas.
El grupo de C.H. Wong utilizó la arteria cerebral media como modelo de experimentación para la enfermedad cerebrovascular. Ellos observaron que los ratones deficientes en células T asesinas naturales invariantes (logrado mediante la ablación de CD1d) y con accidente inducido por la oclusión de la arteria cerebral media, presentaban un aumento de la carga bacteriana en los pulmones, mayor daño inflamatorio pulmonar y disminución de la supervivencia, en comparación con los ratones tipo salvaje, mientras que la severidad del accidente cerebrovascular fue similar en ambas cepas. El tratamiento antibiótico profiláctico evitó completamente la muerte en ratones CD1d-/-, un hallazgo que sugiere que la falta de células T asesinas naturales invariantes los hacía más susceptibles a la muerte por infecciones después del evento cerebrovascular.
Las células T asesinas naturales invariantes son un subconjunto único de linfocitos que expresan un repertorio muy restringido de receptores de células T. Estos receptores reconocen glicolípidos endógenos o microbios específicos presentados por el complejo mayor de histocompatibilidad de clase I CD1d. Se cree que desempeñan un papel crítico en las defensas del huésped a los diferentes patógenos debido a la activación de las células T asesinas naturales invariantes por ligandos de CD1d o por citoquinas inflamatorias que llevan a la rápida secreción de citoquinas (como el interferón-γ) y quimiocinas, las que contribuyen al reclutamiento y activación de otros subconjuntos de leucocitos, incluyendo neutrófilos y macrófagos durante la infección. Las células T asesinas naturales invariantes residen en el sistema vascular, principalmente en el hígado y el bazo, por lo tanto están en condiciones de responder a señales moleculares de la lesión a distancia, como en el cerebro.
En el estudio de Wong y colegas, el accidente cerebrovascular no se tradujo en una pérdida de células T asesinas naturales invariantes en los animales tipo salvaje, pero el análisis fenotípico de estas unidades reveló una mayor activación y cambios de comportamiento en el hígado poco después de la oclusión de la arteria cerebral media. Curiosamente, en lugar de producir los linfocitos T cooperadores tipo 1 inflamatorios (Th1), se expresaban altos niveles linfocitos T cooperadores tipo 2 inmunosupresivos (Th2). El aumento de los niveles séricos de citoquinas Th2 disminuyó las concentraciones de citoquinas Th1, indicando un cambio general hacia una respuesta inmune anti-inflamatoria después de una apoplejía, un fenómeno implicado en el deterioro de la respuesta anti-bacterial post-isquémica del paciente. Debido a que la literatura ha sugerido un papel importante del sistema nervioso en la respuesta inmune después de una lesión aguda y de infecciones, el equipo de Wong investigó el efecto del bloqueo de la señalización simpática noradrenérgica en la función de las células T asesinas naturales invariantes postisquémicas. La administración propranolol, un beta bloqueador de los receptores β1-adrenérgicos, no sólo revirtió la variación de citoquinas por las células asesinas naturales invariantes T hacia un fenotipo dominado por células Th1, sino que también evitó completamente las infecciones bacterianas después del accidente cerebrovascular. Es importante destacar que los autores encontraron que el efecto protector de la señalización de bloqueo noradrenérgico dependía de la presencia de células T asesinas naturales invariantes: la adición de propranolol en ratones CD1d-/- (es decir, deficientes en células T asesinas naturales invariantes), no protegía de la infección o la muerte.

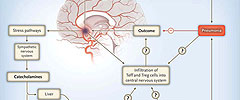
El derrame cerebral induce la inmunosupresión, que se caracteriza por la alteración de la función de las células T asesinas naturales invariantes (así como otras células inmunes, incluyendo las células T y células presentadoras de antígenos) a través de la sobre-activación de las vías de estrés, especialmente las del sistema nervioso simpático, en las vísceras y los órganos linfáticos. La degradación resultante de las defensas de los antimicrobianos, junto con déficits neurológicos (por ejemplo, la disfagia y pérdida del conocimiento), con frecuencia conducen a la neumonía, que a su vez, puede empeorar el resultado. Un reciente estudio de C.H. Wong y colegas apoya la idea que la inmunoestimulación o el bloqueo de las vías de estrés puede mejorar los resultados en personas con accidente cerebrovascular, restaurando la función inmune y evitando las infecciones. Sin embargo, las células inmunes periféricas, incluyendo las células T efectoras (Teff) y las T reguladoras (Treg), se infiltran en el sistema nervioso central después de la isquemia, lo que puede tener efectos destructivos, de protección o de regeneración en el cerebro, lo que sugiere que se requiere más investigación para desentrañar las potenciales consecuencias de las terapias inmunomoduladoras en pacientes con ictus.
La investigación de C.H. Wong amplió los hallazgos previos sobre el importante papel de la activación simpática en la inmunosupresión después del accidente cerebrovascular al destacar el defecto celular inducido por el accidente vascular en la defensa anti-bacterial temprana al empeorar la función de las células T asesinas naturales invariantes (fig. 1). Desde el punto de vista clínico, este estudio sugiere un nuevo enfoque terapéutico para prevenir el accidente cerebrovascular asociado a infecciones. La administración de α-galactosilceramida, un activador de las células T asesinas naturales invariantes, aumentó los niveles sistémicos del interferón-γ y redujo las infecciones bacterianas y el daño pulmonar en ratones tipo salvaje después de la isquemia. Por lo tanto, la inmunomodulación selectiva puede ser superior a las estrategias de tratamiento que implican el uso de los antibióticos que induzcan resistencia.
Sin embargo, se recomienda la traducción de los hallazgos científicos al ámbito clínico. La inmunosupresión después de una lesión aguda del sistema nervioso central puede proteger contra el daño cerebral evitando las nocivas respuestas inmunes dirigidas al sistema nervioso (fig. 1). Por ejemplo, las células T γδ, que son cruciales para la defensa antibacterial, han demostrado tener efectos perjudiciales en el accidente cerebrovascular mediante la promoción del daño cerebral isquémico. Por lo tanto, se necesita más investigación para comprender mejor el mecanismo de interacción inmune cerebral después de una lesión aguda y las consecuencias a largo plazo que los tratamientos inmunomoduladores pueden tener en los pacientes con ictus.
Fuente bibliográfica
Suppressing Immunosuppression after Stroke
Christian Meisel, M.D., and Andreas Meisel, M.D.
Institute of Medical Immunology (C.M.) and the Neuro-Cure Clinical Research Center, Department of Neurology (A.M.), Charité-University Medicine, Berlin.
N Engl J Med 2011; 365:2134-2136