Diarrea infecciosa: simple pero difícil de tratar
Las enfermedades diarreicas se encuentran entre las principales causas de muerte en los países en desarrollo, especialmente en niños. Aunque muchas de las vacunas aplicadas por vía parenteral son muy eficaces en la prevención de las condiciones infecciosas sistémicas, con frecuencia esta forma da como resultado una débil protección contra los enteropatógenos. Esto, principalmente, por el hecho que tanto las células T efectoras y células plasmáticas productoras de anticuerpos inducidas por antígenos no expresan moléculas mensajeras en el intestino y, en consecuencia, no existe un escudo protector en la mucosa intestinal correctamente desarrollado.
Por otro lado, está bien documentado que la adecuada aplicación oral de las vacunas induce la inmunidad protectora de la mucosa intestinal. De hecho, varios estudios han demostrado que esta estrategia de vacunación genera una protección mucho más potente en la mucosa que la inmunización sistémica. Por desgracia, en los países en desarrollo, varias vacunas orales han fracasado en comparación con su efecto en los países industrializados. Los factores responsables de esta inadecuada protección incluyen el saneamiento deficiente, mal funcionamiento digestivo y de absorción, crecimiento excesivo de la flora intestinal, y deficiencia de vitamina A en las mismas vacunas. Por otra parte, la vacunación por vía oral puede resultar en tolerancia inmune cuando se utiliza como antígeno o material muerto o de baja virulencia. En conjunto, estos resultados subrayan la urgente necesidad de producir vacunas que generen una inmunidad eficaz y duradera en el tracto digestivo.
Inmunidad de la mucosa
A veces las cosas simples son difíciles de manejar. Este es el caso de la diarrea infecciosa, que sigue siendo una de las principales causas de mortalidad infantil a nivel mundial y un factor importante de morbilidad a largo plazo. Algunas infecciones intestinales rápidamente se convierten en sistémicas, con efectos mortales, incluso en adultos, como lo demuestra el brote de una enfermedad asociada con la toxina Shiga de la Escherichia coli producida este verano en Europa. Durante mucho tiempo se ha intentado que las vacunas protejan al intestino de los patógenos y sus toxinas. Sin embargo, la búsqueda ha resultado difícil debido a que la vía convencional de inmunización - por inyección a través de la piel - suele generar inmunidad sistémica, pero con poca o ninguna protección en la superficie de la mucosa, mientras que la inmunización de la mucosa tiene como objetivo la respuesta inmune de la membrana pero a menudo obstaculizada por la insuficiente potencia, la falta de seguridad, o ambas cosas. Un nuevo estudio realizado por Swantje I. Hammerschmidt y colaboradores (J Clin Invest 2011 July 1) llama la atención sobre el problema.
La inmunización eficaz requiere el procesamiento y presentación del antígeno por las células dendríticas en yuxtaposición con las células T “ingenuas”. Esta presentación se produce sólo cuando las dos células se encuentran en órganos linfoides secundarios, como los ganglios linfáticos de drenaje de la piel o agregados linfoides que recogen los antígenos de superficie de la mucosa, como las del intestino (placas subepiteliales de Peyer y ganglios linfáticos mesentéricos), los pulmones y otros sitios que están abiertos al medio ambiente. En los ganglios linfáticos, las células dendríticas migran desde la periferia, cargadas con antígenos exógenos y activadas por "señales de peligro”, identificando las células T ingenuas que son las únicas capaces de reconocer el antígeno e inducirlos a proliferar y diferenciarse en uno de las varios fenotipos de células T efectoras. Las células dendríticas también generan instrucciones para que las células T efectoras puedan migrar, establecer la inmunidad local y luchar contra la infección cuando sea necesario.
Ahora sabemos que las células T ingenuas están impresas por las células dendríticas para que migren hacia el intestino delgado. A diferencia de las células dendríticas en otros tejidos linfoides, las de las placas de Peyer y ganglios linfáticos mesentéricos poseen enzimas que convierten la vitamina A de la dieta en ácido trans-retinoico. Por lo tanto, la presencia de éste es un rasgo característico del medio ambiente linfoide del intestino (figura 1B). El ácido trans-retinoico, durante la presentación del antígeno, induce a las células B y células T para que expresen en su superficie la integrina α4β7 que une la molécula de citoadhesión adresina mucosal (MAdCAM-1) - un receptor de adhesión específica a la mucosa células endoteliales microvasculares - y el receptor de quimiocina CCR9 enlazado a CCL25, una quimiocina que es expresada constitutivamente en el intestino delgado. Cuando los linfocitos activados retornan a los tejidos linfoides de la mucosa en la sangre, el tráfico de estas dos moléculas (llamadas "receptores de alojamiento") permite a las células efectoras migrar a la mucosa intestinal (figura 1). Sin embargo, si el ácido trans-retinoico no está presente, por ejemplo cuando las células dendríticas y células T vírgenes se encuentran en los ganglios linfáticos de drenaje de la piel, las células T son inducidas a expresar otros receptores mensajeros que dirigen las células T a la piel (figura 1C). Las células efectoras resultantes pueden acumularse en la piel pero con un trayecto deficiente hacia el estómago, por lo que a menudo la vacunación percutánea produce una inadecuada protección de la mucosa.
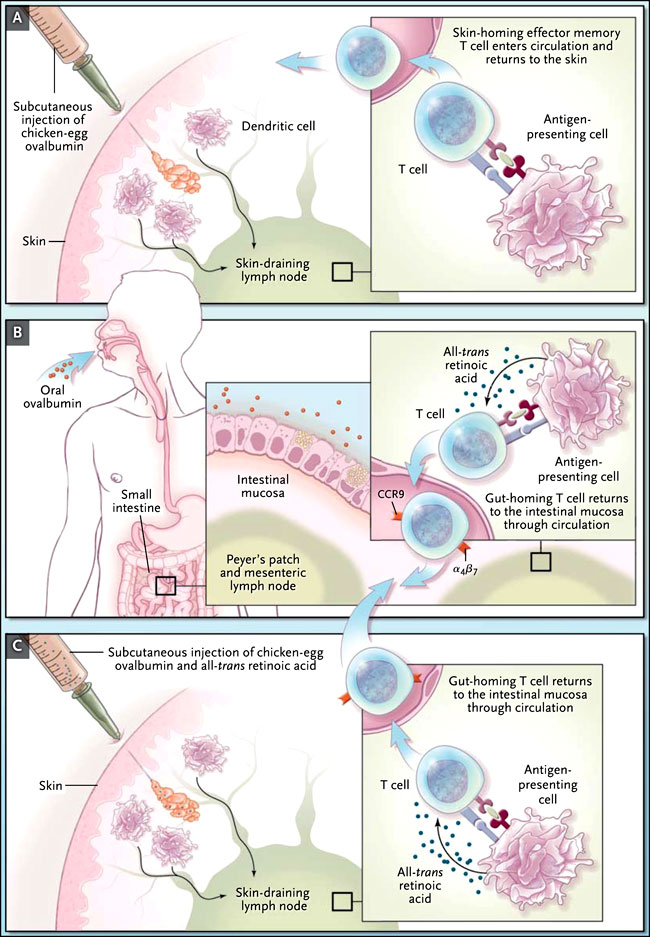
La reciente investigación realizada por Swantje I. Hammerschmidt y colegas, describe un método para obtener inmunidad de la mucosa. Se inmunizaron ratones contra la ovoalbúmina de pollo mediante inyección subcutánea (grupo A) o por sonda nasogástrica con ovoalbúmina administrada directamente a la mucosa intestinal (grupo B) o mediante una inyección subcutánea de ovoalbúmina más ácido trans-retinoico (grupo C). Las integrinas CCR9 y α4β7 son receptores de alojamiento para el paso de células T a la mucosa del intestino delgado. Las células dendríticas procesaron la ovoalbúmina y presentaron los péptidos de ovoalbúmina a las células T en las zonas periféricas de los nódulos linfáticos de drenaje de la piel (grupo A) o de la placa de Peyer y en ganglios linfáticos mesentéricos (grupo B). La vacunación por vía subcutánea, junto con el ácido trans-retinoico, resultó en el procesamiento de antígenos en los ganglios linfáticos de drenaje y en células T que estaban programadas para su alojamiento en el intestino, en vez de retornar a la piel (grupo C).
Aunque aparentemente es una simple propuesta, la inmunización a través del intestino ha sido extremadamente problemática, porque el órgano se organiza para promover la tolerancia inmune, no la inmunidad a los antígenos administrados por vía oral, por eso la gente normalmente no es alérgica a los alimentos. Para solucionar este problema, el equipo de S. Hammerschmidt postuló que las vacunas aplicadas por vía subcutánea eran capaces de inducir a los linfocitos intestinales de alojamiento (y por lo tanto la inmunidad intestinal) si la inyección contenía ácido trans-retinoico. Esto es exactamente lo que encontraron. Ellos inmunizaron ratones con ovoalbúmina de huevo de gallina por vía subcutánea con o sin ácido trans-retinoico o mediante una sonda nasogástrica con albúmina sola, administrada directamente a la mucosa intestinal (figura 1). Para vigilar el tráfico de los antígenos específicos de linfocitos, los ratones fueron infundidos con células T ingenuas fluorescentes. El ácido trans-retinoico aplicado por vía subcutánea, junto con la ovoalbúmina, generó que las células T transferidas expresaran receptores de alojamiento del intestino y migraran allí y actuaran en número similar a los inducidos por la inmunización oral con ovoalbúmina sola, si bien en dosis 1.000 veces superior a las de la inyección subcutánea. Cabe destacar que las vacunas por vía subcutánea en contra de la toxina del cólera y la salmonella, cuando se aplican con ácido trans-retinoico, inducen una considerable protección contra la enfermedad. En resumen, el ganglio linfático de drenaje de la piel se convirtió de un sitio que especifica la defensa inmune cutánea en un lugar con inmunidad intestinal específica (de la mucosa).
Este es un descubrimiento importante, coincidentemente compartida en parte por Xuefang Tan y colaboradores (J Virol 2011; 85:8316-8327). Ambos grupos han aplicado con elegancia el conocimiento de cómo el ácido trans-retinoico actúa en la presentación de antígenos, demostrando una estrategia para su aplicación clínica. Este enfoque es atractivo debido a que la respuesta inmune en ganglios linfáticos de drenaje de la piel está mejor definida y es más vigorosa que la de los tejidos linfoides de la mucosa. Sin embargo, la administración de ácido trans-retinoico tiene conocidos efectos mutagénicos tóxicos que son de preocupación cuando se le considera en vacunas para niños sanos y en mujeres de edad fértil. Otra posible limitación es que el ácido trans-retinoico se activa en los linfocitos del intestino delgado, pero no necesariamente en otras superficies de la mucosa, como la de colon. Sin embargo, el estudio de Swantje Hammerschmidt describe cómo, en principio, el problema de la inmunización de la mucosa se podría abordar. El enfoque requiere investigación adicional, pero sería prematuro abandonar los esfuerzos para desarrollar técnicas que permitan la administración oral del antígeno y el adyuvante para la vacunación de la mucosa.
Fuente bibliográfica
Eliciting Mucosal Immunity
Wayne I. Lencer, M.D., and Ulrich H. von Andrian, M.D., Ph.D.
Department of Medicine (W.I.L.) and the Program in Cellular and Molecular Medicine (U.H.A.) — Children’s Hospital, Harvard Medical School, Boston.
N Engl J Med 2011; 365:1151-1153