Lipasas, caquexia y cáncer
La caquexia es un trastorno que se caracteriza por la pérdida de tejido adiposo y músculo esquelético. Se trata de un problema particular en pacientes con cáncer gastrointestinal, de hecho, se cree que es la causa inmediata de muerte en el 15% de los individuos con cáncer. Actualmente no hay tratamiento, ya que los suplementos nutricionales tienen poco o ningún efecto sobre las pérdidas. La patogénesis es multifactorial y se entiende de manera incompleta, pero las recientes investigaciones señalan la presencia de anomalías en los triglicéridos, las cuales desempeñarían un papel clave. Esta falla estaría mediada por los niveles de las enzimas lipasa adiposa de triglicéridos y la lipasa sensible a hormonas.
Urge aumentar los conocimientos sobre los mecanismos subyacentes a la caquexia y el cáncer, ya que se sabe que la inhibición farmacológica de las lipasas podría presentar una posibilidad de tratamiento en estos pacientes. Sin embargo, debe considerarse que la deficiencia de la lipasa adiposa de triglicéridos en humanos conlleva la acumulación masiva de triglicéridos y posteriores miocardiopatías, planteando dudas sobre la posibilidad de dirigir futuros tratamientos hacia esta particular lipasa.
Caquexia por cáncer y fisiología de la grasa muscular
La caquexia afecta a la mayoría de los pacientes con cáncer avanzado y se asocia con una reducción de la tolerancia y respuesta al tratamiento, de la calidad de vida y de la supervivencia. Es un síndrome multifactorial causado por una combinación variable entre la reducción de la ingesta de alimentos y un metabolismo anormal que resulta en el desbalance negativo de energía y proteínas. Representa una pérdida progresiva de masa ósea y muscular, lo que provoca un continuo deterioro funcional. A pesar que los estimulantes del apetito o el apoyo nutricional pueden ayudar a revertir la falta de grasa, la reversión de la pérdida de masa muscular es mucho más difícil y sigue siendo un reto en el cuidado del paciente.
En este ámbito, la pérdida de músculo esquelético es el resultado de un desequilibrio entre la síntesis de proteínas y su degradación. La mayoría de las investigaciones se han centrado en la vía de la ubiquitina-proteasoma, la regulación de las células satélites en el músculo esquelético y la importancia de los receptores relacionados y vías de señalización que probablemente están influenciados por la inflamación sistémica inducida por el tumor. Del mismo modo, la pérdida de tejido adiposo resulta de un desequilibrio en la lipogénesis y la lipólisis, con el incremento de la lipólisis generado por la activación neuroendocrina y factores lipolíticos tumorales, incluyendo citoquinas proinflamatorias y zinc-α2-glicoproteína.
Los estudios sobre la fisiología integrativa de la obesidad y la diabetes se han centrado en la importancia de la inflamación crónica, el aumento de la lipólisis de los adipocitos y el incremento de los niveles circulantes de ácidos grasos durante la competencia entre el tejido muscular y adiposo, lo que contribuye a lipotoxicidad y resistencia a la insulina en el músculo. Del mismo modo, los estudios en fisiología del ejercicio se focalizan en los mecanismos moleculares de dicha competencia que se produce a través de adipocinas y miocinas, y sobre el papel que estas moléculas pueden desempeñar en las enfermedades crónicas. A pesar que la caquexia en pacientes con cáncer se caracteriza por la inflamación sistémica, aumento de la lipólisis, resistencia a la insulina y escasa actividad física, no han sido suficientes los esfuerzos para manipular la fisiología integrativa de los tejidos adiposo y muscular para obtener los respectivos beneficios terapéuticos.
Con este fin, Suman K. Das y colegas (Science 2011 June 16) acaban de publicar los resultados experimentales con dos modelos de ratones en los que se investigaron los aspectos metabólicos y la relación caquexia-anorexia. En estos ratones, durante las fases iniciales e intermedias del crecimiento tumoral y de la caquexia, la ingesta de alimentos se mantuvo normal, mientras que los niveles plasmáticos de citoquinas proinflamatorias y zinc-α2 glicoproteína aumentaron. Los investigadores encontraron que la supresión genética de la lipasa adiposa de triglicéridos impidió el aumento de la lipólisis y la movilización de tejido adiposo asociado con el crecimiento del tumor (figura 1). De forma inesperada, también se observó que la masa del músculo esquelético se conservó y que se evitó la activación de las vías de degradación proteasomal y la apoptosis muscular. La ablación de la lipasa sensible a hormonas presentó efectos similares pero más débiles. Este estudio abre una posibilidad insospechada, ya que la competencia tejido adiposo-músculo es fisiológicamente importante en el contexto de la caquexia por cáncer.
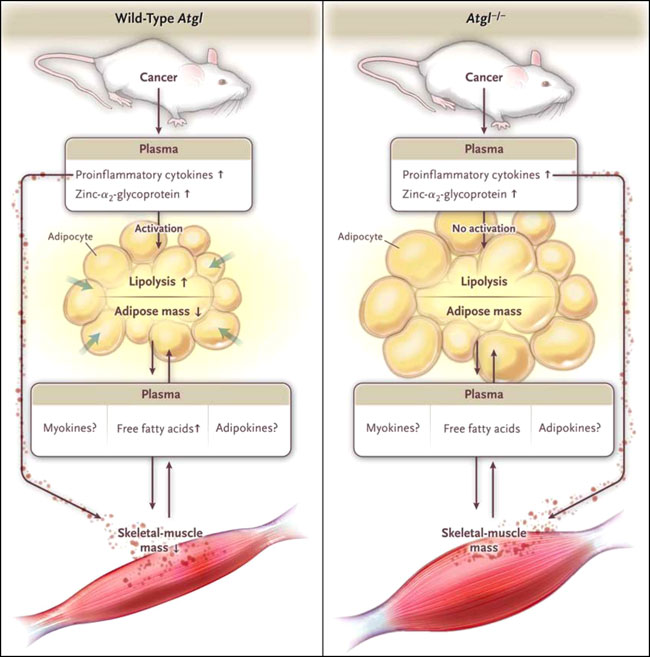
En ratones con tumores y el gen tipo salvaje para la lipasa adiposa de triglicéridos (ATGL, también conocida como Pnpla2), una variedad de mediadores circulantes, incluyendo citoquinas (factor de necrosis tumoral α e interleucina-6) y zinc-α2-glicoproteína, activan a la ATGL, provocando lipólisis y movilización de tejido adiposo blanco y el aumento en los niveles plasmáticos de ácidos grasos libres. Al mismo tiempo, la caquexia - proceso de catabolismo proteico, apoptosis y atrofia muscular - se inicia y puede ser modulada por la interferencia entre el músculo y el tejido adiposo mediada por ácidos grasos libres o por varias adipocinas o miosinas. En ratones portadores de tumores en los cuales se eliminó el gen (ATGL-/-), el mismo patrón de liberación de mediadores no fue capaz de activar la lipólisis, los niveles plasmáticos de ácidos grasos se mantuvieron normales, y la masa del tejido adiposo blanco y del músculo esquelético se conservó. El mecanismo mediante el cual se preserva la masa muscular en presencia de mediadores sistémicos es desconocido, pero puede comprometer a los músculos, al tejido adiposo a través de la competencia entre los tejidos musculares y adiposos mediante los ácidos grasos libres, miocinas o adipocinas. Por otra parte, el mantenimiento de la masa del músculo esquelético puede ser una consecuencia directa de la lipólisis autónoma en el tejido defectuoso.
¿Cuál es la relevancia de estos resultados? Dada la actual epidemia de obesidad en la sociedad occidental en general y en pacientes con cáncer, en particular, la inhibición de la pérdida de grasa no es probablemente una de las prioridades. El problema fundamental sigue siendo la masa muscular, un 50% de las personas con cáncer avanzado tienen sarcopenia. Por otra parte, la menor supervivencia entre pacientes con cáncer avanzado se da en obesos con sarcopenia. En estos individuos, una terapia muscular de preservación, lo que también aumenta la masa grasa, no puede ser ventajosa. Además, hay que considerar que la respuesta metabólica al cáncer es heterogénea, y una terapia que se adapte a una anomalía metabólica puede requerir la caracterización específica e individualizada de los afectados. Por otra parte, la caquexia tiene un espectro de fases (pre-caquexia, caquexia y caquexia refractaria) y grados de severidad. La presente investigación analizó el efecto de la supresión de la lipólisis en el inicio del crecimiento tumoral. Por lo tanto, el modelo no tiene en cuenta el escenario que se produce con frecuencia en la práctica clínica, en la que el cáncer y la caquexia están bien identificados. Finalmente, los pacientes generalmente reciben terapia antineoplásica sistémica en una fecha tardía de la enfermedad, y la interacción de este manejo con el desarrollo de la caquexia (algunos tratamientos pueden inducir la pérdida de masa muscular) se desconoce. En conjunto, estas cuestiones apuntan a la importancia de comprender el mecanismo exacto subyacente de los presentes resultados.
Tradicionalmente, controlar el avance del cáncer es considerado como la mejor manera de contener la caquexia. Sin embargo, el manejo de síntomas por sí solo puede mejorar la supervivencia de los pacientes con cáncer avanzado, y un enfoque multifacético para el manejo ya ha demostrado ser parcialmente eficaz. La creciente comprensión de los mecanismos que sustentan la caquexia ha llevado a un gran número de estudios, ahora en fases 1 ó 2, a centrarse en potentes terapias dirigidas a mediadores del hipoanabolismo y del hipercatabolismo. El estudio realizado por Suman K. Das y colegas sugiere que el lograr una mejor comprensión de la fisiología integradora de este complejo síndrome puede producir enfoques terapéuticos aún más innovadores.
Fuente bibliográfica
Cancer Cachexia and Fat–Muscle Physiology
Kenneth C.H. Fearon, M.D.
Department of Clinical Surgery, School of Clinical Sciences and Community Health, University of Edinburgh, Royal Infirmary, Edinburgh.
N Engl J Med 2011; 365:565-567