SHANK3: la ruta del autismo
El gen SHANK3 codifica para una proteína que está implicada en la formación y el mantenimiento de las sinapsis. Las sinapsis son los puntos de comunicación entre neuronas y son fundamentales para el buen funcionamiento del sistema nervioso. Dependiendo de su ubicación y función, una sola neurona puede establecer sinapsis con 100 neuronas diferentes, o incluso hasta con 1000 más. La red de sinapsis neuronal en el cerebro permite la señalización eléctrica necesaria para funciones muy complejas, tales como la cognición y el lenguaje.
Recientes investigaciones han demostrado que interrupciones en la secuencia de SHANK3 conducen al autismo. Estos resultados y el uso de modelos animales para la enfermedad podrían permitir entender los defectos neuronales responsables de los comportamientos anormales, permitiendo establecer nuevas estrategias y metas para el desarrollo de un tratamiento efectivo de la enfermedad.
SHANK3, sinapsis y autismo
Los trastornos del espectro autista presentan la paradoja de una gran heterogeneidad y especificidad. Más de 100 alteraciones genéticas producen un fenotipo autista, la mayoría a través de mecanismos específicos, pero distintos, y muchos de los cuales afectan a la sinapsis.
Se sabe que el gen SHANK3 (SH3 con múltiples dominios repetidos de ankirina 3) está interrumpido en el síndrome deleción 22q13 (síndrome de Phelan-McDermid), y ciertas variantes se han relacionado con el autismo en algunos pacientes sin deleción 22q13 y esquizofrenia o discapacidad intelectual que no tienen autismo. Utilizando animales, João Peça y colaboradores (Nature 2011; 472:437-442) han avanzado sobre el conocimiento de SHANK3 y el autismo a través de la evaluación de las funciones de genes ortólogos (Shank3) de ratón. Al hacerlo, han proporcionado un ejemplo de las profundas contribuciones de la neurociencia molecular en el discernimiento de los mecanismos internos de las manifestaciones conductuales de los trastornos del espectro autista y han dilucidado el camino de los enlaces de traslación en este trastorno, que tiene consecuencias devastadoras para salud pública e individual y costosas implicaciones económicas.
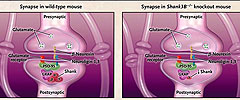
La familia de proteínas Shank proporciona la estructura para la señalización molecular en la densidad postsináptica (un complejo multiproteico unido a la membrana postsináptica) de las sinapsis glutamatérgicas, por lo que estas moléculas son vulnerables a mutaciones Shank3. Al centrarse en zonas separadas de Shank3, los autores diseñaron dos modelos murinos, cada uno albergando diferentes alelos mutantes del gen. Cada alelo tenía efectos distintos sobre las tres isoformas de Shank3: α, β y γ. Los Ratones modificados faltantes de expresión de la isoforma α, pero no de las β y γ, mostraron pocos cambios de comportamiento en comparación con los controles. Pero los animales Shank3B-/-, en el que las isoformas Shank3α y Shank3β estaban ausentes y el nivel de Shank3γ era notablemente reducido, tenían una forma de autismo con características de comportamiento que no podían ser explicadas por la crianza. Estas incluían la ansiedad, conducta de auto-lesión, evitación de la interacción social y escasa percepción social (figura 1).
SHANK3 está altamente expresado en zonas estriadas de humanos y ratones. La estriada de Shank3 -/- en ratones mostraron varias características microanatómicas consistentes con una menor intensidad de la señalización neuronal. La densidad postsináptica era más fina y corta que los de los ratones normales, y menor nivel de proteínas estructurales y de las subunidades del receptor de glutamato.

La anulación de SHANK3 en ratones genera la eliminación de las isoformas Shank3α y Shank3β y una reducción de Shank3γ en la densidad postsináptica. Los niveles de las proteínas estructurales, incluida la proteína asociada a la guanilato quinasa (GKAP, también conocida como SAPAP), y varias subunidades del receptor de glutamato disminuyen (panel A). Además de formar una especie de andamio en la sinapsis glutamatérgica, el complejo proteico PSD-95-GKAP interactúa con otras proteínas sinápticas en la densidad postsináptica (panel B, flechas), también se muestran los contactos sinápticos con vesículas presinápticas (puntas de flecha) y la espina dendrítica (estrellas). Las dendritas de los ratones mutantes muestran más arborización y las espinas una menor densidad en comparación con ratones tipo salvaje (panel C), comprometiéndose la amplitud y frecuencia de los potenciales de acción. Aunque el tamaño total del cerebro en ratones mutantes no es diferente de la de ratones normales, el cuerpo estriado es ligeramente más grande (panel E). Las manifestaciones conductuales asociadas a estos cambios neurobiológicos son de tipo autista, incluyendo una menor interacción social, menos búsqueda de la novedad social, preparación excesiva y comportamiento autolesivo.
De acuerdo con esta observación, la intensidad de la señal fue relativamente más baja en el circuito sináptico corticostriatal, así como la estimulación, la amplitud y la frecuencia de los potenciales de acción. Esta reducción de la actividad postsináptica parecía estar restringida en el cuerpo estriado.
También se encontraron cambios celulares pertinentes a intensidad de la señal: la arborización de las dendritas de las neuronas espinosas era más compleja, con más dendritas y mayor superficie. Este hallazgo es consistente con el tamaño del cerebro en muchos niños con trastornos del espectro autista (aunque podría haber otras explicaciones para esto). A pesar que el tamaño total del cerebro no aumentó en ratones Shank3B-/-, se observó un pequeño incremento, pero significativo, en el volumen del caudado, una mayor caudado se ha observado en personas con trastornos del espectro autista y podría estar relacionado con las conductas repetitivas que son características en el espectro autista.
¿Podría ser el desarrollo de dendritas más largas y complejas la respuesta compensatoria de las neuronas a un debilitamiento de la función sináptica? ¿Si la célula está programada para esperar un cierto nivel de estímulo que no llega, podrían las dendritas buscar más información? Sin embargo, al mismo tiempo, estas extensas dendritas tendrían menos espinas, a pesar que el ancho de la columna vertebral fuera ligeramente mayor que en los controles.
¿A qué nivel pueden los autores esclarecer los múltiples niveles del fenotipo de Shank3B-/- para generalizar a través de muchas mutaciones diferentes o mecanismos? Los métodos aplicados para identificar este conjunto de anomalías también se pueden utilizar para profundizar en los componentes moleculares, anatómicos, funcionales y en otras variedades de la disfunción sináptica, que igualmente contribuirían a la heterogeneidad de los trastornos del espectro autista. Dada la complejidad molecular de la densidad postsináptica, uno podría imaginar muchas alteraciones genéticas diferentes (o para el caso, las influencias fisiopatológicas o xenobióticos) que pueden comprometer la amplitud y frecuencia del potencial de acción. SHANK3 se expresa también en el intestino, el riñón y otros tejidos del cuerpo, desempeñando un papel en el desarrollo del epitelio e inmunológico de la mucosa y, además, SHANK3 es reclutado por patógenos intestinales en la inducción de la reorganización de la actina. Estas observaciones sugieren que los efectos sistémicos de las alteraciones en SHANK3 podrían contribuir a las características sistémicas de los trastornos del espectro autista observados en muchos pacientes. Es importante aplicar una visión amplia, ya que en la actualidad, la gran mayoría de los casos son idiopáticos, y las influencias del medio ambiente heterogéneo y la variación genética pueden contribuir a las perturbaciones sinápticas y a la variabilidad fenotípica.
Una de las novedades más interesantes en el estudio de los trastornos del espectro autista es la evidencia emergente de la remisión transitoria o persistente. Intervenciones moleculares han revertido los síntomas en modelos animales de los tres síndromes genéticos asociados con el trastorno del espectro autista: el síndrome del X frágil, el síndrome de Rett y la esclerosis tuberosa. Los síntomas del trastorno del espectro autista pueden remitir de forma transitoria con la fiebre, el tratamiento con esteroides, o una dieta restringida en líquidos claros como preparación para un procedimiento médico. Además, hasta en un 20% de los niños con trastornos del espectro autista, los síntomas parecen disminuir después de una intervención intensiva. Cabe destacar que el conjunto de comportamientos autistas en este modelo se produjo sin un completo knock-out de SHANK3: se mantuvo una expresión significativa de la isoforma Shank3γ. ¿Podrían estos efectos haber sido causados por las perturbaciones en el empalme de la transcripción primaria de SHANK3? Tales mecanismos pueden contener elementos de reversibilidad.
Fuente bibliográfica
SHANK3, the Synapse, and Autism
Martha R. Herbert, M.D., Ph.D.
Massachusetts General Hospital and Harvard Medical School
N Engl J Med 2011; 365:173-175