Malaria, tolerancia en lugar de resistencia
La malaria causa alrededor de 250 millones de casos de fiebre y un millón de muertes al año. La gran mayoría ocurren en niños menores de 5 años de edad, y las mujeres embarazadas son especialmente vulnerables. A pesar de los esfuerzos para reducir su transmisión y mejorar el tratamiento, existen pocos cambios en las áreas de alto riesgo. Si la prevalencia de la malaria sigue aumentando, la tasa de mortalidad podría duplicarse en los próximos veinte años.
Enfermedad de células falciformes y control de la malaria
La malaria, especialmente la infección por Plasmodium falciparum, ha ejercido una fuerte presión selectiva sobre el genoma humano. Las personas que son homocigotas para la mutación de la hemoglobina falciforme (una valina reemplaza al ácido glutámico en la posición 6 de la cadena β-globina de la hemoglobina A, generando hemoglobina S) tienen una afección hematológica grave, pero aquellas que son heterocigotas para la mutación (y tienen hemoglobina AS) son asintomáticas y están relativamente protegidas contra la malaria en comparación con aquellos individuos que tienen una hemoglobina normal. Un reciente estudio realizado por Ana Ferreira y colegas (Cell 2011; 145:398-409) nos ofrece una mejor comprensión de cómo la hemoglobina AS protege contra la malaria, proporcionando información sobre los posibles medios de tratamiento y control.
Las consecuencias de la infección por P. falciparum van desde la parasitemia asintomática a la afección grave y a menudo mortal. Las repetidas infecciones llevan a la adquisición gradual de inmunidad en regiones donde es endémica, pero los mecanismos siguen siendo poco conocidos. Además, las razones por las que algunas infecciones progresan de parasitemia asintomática a enfermedad sin complicaciones febriles o a graves manifestaciones clínicas tampoco son tan claras.
El grupo de A. Ferreira utilizó un modelo animal para la enfermedad de células falciformes - en el que ratones expresaban la β-globina humana con la mutación falciforme y dos alteracioness adicionales - para profundizar en los mecanismos de protección contra la malaria en personas con hemoglobina AS. Los investigadores infectaron a los animales con el parásito Plasmodium berghei, que origina una enfermedad grave con características similares a la malaria cerebral, una de las manifestaciones más graves en la infección humana por P. falciparum. Como se ha visto en estudios previos, cuando los ratones fueron inoculados con P. berghei, aquellos con la mutación de células falciformes tuvieron una incidencia significativamente menor de malaria cerebral que los tipo salvaje. Ferreira y colegas sugirieron que el mecanismo de protección en ratones con mutación de células falciformes se debe a tolerancia en lugar de resistencia, ya que los animales adquirieron la misma densidad de parásitos que los tipo salvaje, sin embargo, estaban protegidos contra la malaria cerebral. Esta protección se siguió a la inducción de la expresión de la hemo oxigenasa-1, una enzima que descompone el grupo hemo libre. Por lo tanto, se inhibió la acumulación de hemo, limitando la severidad de la enfermedad.
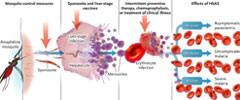
Este nuevo estudio presenta limitaciones en su capacidad para enseñarnos acerca del mecanismo de protección contra la malaria en personas con hemoglobina AS. En primer lugar, los ratones transgénicos estudiados ofrecen un modelo crudo de la condición, especialmente en cuanto a la naturaleza de la protección ofrecida por la hemoglobina AS contra la malaria grave. En segundo lugar, la enfermedad causada por la infección con P. berghei en ratones difiere de la infección con P. falciparum en humanos, por lo tanto, la aplicación de los resultados del estudio en ratones con P. berghei a la malaria cerebral humana pasaría a ser controversial. En tercer lugar, los efectos de la mutación falciforme en ratones pueden no representar a los observados en seres humanos con hemoglobina AS, ya que en los roedores, la protección contra la malaria cerebral no estuvo acompañada de disminución de las cargas parasitarias, mientras que en la mayoría de los ensayos en humanos, las personas con hemoglobina AS que presentan con síntomas de malaria tienen menores cargas parasitarias que aquellas con hemoglobina normal (figura 1).

Oportunidades para la intervención en la progresión de la infección con P. falciparum por la picadura de un mosquito anofeles hacia la enfermedad clínica. De izquierda a derecha, se muestran los puntos en el que varias medidas de control ejercen sus resultados. En el extremo derecho se observa el efecto relativo del genotipo para la hemoglobina AS (HbAS) en las manifestaciones clínicas de la malaria.
No obstante estas limitaciones, el estudio nos ofrece elementos de reflexión sobre el tratamiento y control de la malaria. En lo que respecta al tratamiento de la forma severa, la estimulación farmacológica de la producción de hemo oxigenasa o monóxido de carbono podría mitigar la rápida progresión, teniendo el potencial de salvar vidas. Es de notar, sin embargo, que la faceta más importante del tratamiento seguirá siendo un manejo rápido para eliminar la infección parasitaria, y en este sentido, la reciente creación del artesunato intravenoso de acción rápida representa un importante avance.
En lo que respecta al control de la malaria, el estudio destaca la importancia de los factores del huésped, además de los efectos antiparasitarios directos, para prevenir la progresión de la forma clínica (figura 1). Las medidas de control destinadas a prevenir las picaduras de mosquitos, tales como el uso de mosquiteros impregnados de insecticida y el rociamiento de interiores, están diseñadas para evitar la transmisión de la malaria, pero también pueden impedir la adquisición de inmunidad contra la enfermedad y de tolerancia, disminuyendo la protección contra enfermedades graves. Otras medidas de control - como las vacunas contra los esporozoitos (que se inyectan mediante una picadura de mosquito) o los parásitos del estadio en el hígado - y los fármacos utilizados para el tratamiento preventivo o quimioprofilaxis, pueden permitir la infección y por lo tanto la adquisición de tolerancia o inmunidad sin progresión hacia la enfermedad sintomática. Es importante destacar que las respuestas a parásitos en fase hepática generan una protección completa incluso si los sujetos reciben fármacos para prevenir la enfermedad causada por parásitos eritrocíticos, lo que sugiere que las vacunas o medicamentos que promueven una infección temprana pero no sintomática, permiten una estrategia prometedora para la prevención del desarrollo de la malaria potencialmente mortal sin impedir el desarrollo de una respuesta contra la malaria.
Aunque tenemos un largo camino por recorrer para erradicar la malaria, el uso de medidas que mejoran su control se incrementando en todo el mundo. Una mejor comprensión de cómo la evolución humana - en este caso, la persistencia del genotipo AS - ha promovido un medio de protección contra la forma grave, proporcionaría pistas acerca de qué nuevas estrategias se pueden utilizar para tratar el paludismo y para disminuir su incidencia, sin aumentar la posibilidad que aquellos infectados transiten hacia una enfermedad más crítica.
Fuente bibliográfica
Lessons from Sickle Cell Disease in the Treatment and Control of Malaria
Philip J. Rosenthal, M.D.
University of California, San Francisco, San Francisco.
N Engl J Med 2011; 364:2549-2551