El peligroso viaje del meningococo
Aunque en la mayoría de los casos la presencia de Neisseria meningitidis localizada en la garganta no tiene consecuencias, en algunos puede causar meningitis o septicemia. Recientemente, se ha descubierto la forma como esta bacteria difunde, dejando la garganta para pasar al torrente sanguíneo. Estos microorganismos colonizan la faringe humana empleando finos orgánulos filamentosos conocidos como formaciones pilosas, o pili, tipo IV. Sin embargo, como la bacteria se multiplica y forma una colonia en el tejido del huésped, la transcripción de un gen bacteriano que codifica una enzima que recubre los pili con fosfoglicerol se pone en marcha.
Este gen sólo es completamente funcional cuando el germen está en contacto con las células que recubren la pared de la garganta. Esta actividad hace que la bacteria pierda la capacidad de formar agregados y, como consecuencia, una pequeña proporción es liberada para viajar a cualquier localización y colonizar nuevos tejidos y huéspedes. Dicha estrategia es utilizada por las bacterias para invadir otras áreas de la garganta y atravesar las células que la recubren.
Diseminación
La Neisseria meningitidis es un patógeno importante que sigue siendo causa de enfermedades endémicas y epidémicas en humanos. La exposición inicial se produce normalmente en la nasofaringe, donde las bacterias pueden invadir el epitelio de la mucosa, causar sepsis fulminante, y difundirse en el sistema nervioso central, causando la meningitis bacteriana. Recientemente, Julia Chamot-Rooke y colegas (Science 2011; 331:778-782) describen una propiedad única de su virulencia en el que los pili de la superficie bacteriana, después del contacto con las células huésped, sufren una modificación que facilita la invasión sistémica y la propagación de la colonización.
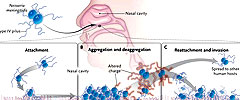
Se extienden de persona a persona dando lugar a epidemias en la comunidad, con importantes consecuencias para la salud pública. En países de escasos recursos, los brotes cíclicos seguirán dando lugar a una elevada mortalidad y discapacidad a largo plazo, especialmente en el África subsahariana, donde está limitado el acceso al diagnóstico temprano, tratamiento con antibióticos y vacunación. Como patógeno exclusivamente humano, la N. meningitidis utiliza varios factores de virulencia para causar la enfermedad. Altamente presentes, los polisacáridos capsulares hidrofílicos protegen a la bacteria de la fagocitosis y la actividad bactericida mediada por el sistema inmune innato. Una familia de proteínas (llamadas proteínas de opacidad) en la membrana externa de la bacteria facilita las interacciones con las células epiteliales y endoteliales. Estas proteínas son de fase variable, es decir, el genoma de la bacteria codifica proteínas relacionadas con la opacidad que se expresa de forma variable, en función del entorno, permitiendo que el microorganismo pueda adaptarse a las cambiantes condiciones ambientales. El lipooligosacarido, un análogo a la de lipopolisacárido bacterias gram-negativas entéricas, contiene un lípido A con actividad endotoxina que promueve la sepsis sistémica encontrada clínicamente. Sin embargo, el apego inicial a las células huésped está mediado por orgánulos filamentosos denominados pili tipo IV, que son comunes a muchos patógenos bacterianos y únicos en su capacidad para sufrir tanto la variación antigénica como de fase. A las pocas horas de apego a la célula endotelial del huésped, la N. meningitidis induce la formación de protuberancias en la membrana plasmática de la célula huésped que se agregan las bacterias en microcolonias y facilita los contactos entre las bacterias y entre las bacterias y las células del huésped. Después de la unión y agregación, la N. meningitidis se desprende de los agregados para invadir sistemáticamente al hospedador, a través de una vía transcelular que atraviesa el epitelio respiratorio, o se convierte en aerosol y extiende la colonización a nuevos huéspedes (figura 1).

Este estudio determinó que el paso inicial en la colonización de la mucosa respiratoria es la unión facilitada por el pili tipo IV (panel A). Después de esto, las bacterias se multiplican y se agrupan, pero dentro de cuatro horas la expresión de la fosfotransferasa pilina se ha incrementado, esta enzima modifica el pili a través de fosfoglicerol, alterando la carga de pilina, la subunidad estructural del pilus (panel B). La carga alterada, a su vez, promueve la desagregación de las bacterias, las que pueden conectarse a nuevas células de la mucosa (incluidos otros contactos humanos) e invadir el epitelio de la mucosa por extensión sistémica (panel C).
El grupo de Chamot-Rooke analizó el mecanismo molecular que subyace a esta etapa crítica de la invasión sistémica y la propagación de persona a persona e informó que la patogénesis depende de una única modificación después de la traducción del pili tipo IV. Utilizando una espectroscopia de masas de proteínas, microscopia electrónica, y el modelado molecular, se demostró que el componente principal del pili tipo IV (llamado PilE o pilina) de N. meningitidis sufre una modificación inusual después de la traducción por el fosfoglicerol. La expresión de la fosfotransferasa pilina, enzima que transforma el fosfoglicerol en pilina, se incrementa dentro de las 4 horas de contacto del meningococo con las células huésped y modifica el residuo de serina en el aminoácido 93 de la pilina, alterando la carga de su estructura y desestabilizando con ello las estructuras pili, reducción de la agregación bacteriana, y el desprendimiento de la superficie celular. Las cepas de N. meningitidis, en que la modificación del fosfoglicerol ocurre, tienen una habilidad mucho mayor para cruzar las monocapas epiteliales, un hallazgo que apoya la opinión de que esta propiedad de virulencia, que provoca la desagregación, promueve la transmisión a nuevos huéspedes y la invasión sistémica.
A pesar que esta nueva comprensión molecular de la virulencia de N. meningitidis en los seres humanos es provocativa, existen muchas preguntas sin respuesta. ¿En concreto, la modificación del pili por el fosfoglicerol restringe a ciertos clones de N. meningitidis? ¿Las modificaciones en los pili son influenciadas por la infección viral concomitante del tracto respiratorio superior o afectadas por la comunidad bacteriana de la flora comensal de la nasofaringe? ¿La modificación del pili influye en la capacidad de N. meningitidis para cruzar el endotelio de la barrera sangre-cerebro?
El estudio de Chamot-Rooke y colegas contribuye a sustentar la perspectiva que las intervenciones dirigidas a las propiedades de virulencia de las bacterias pueden tener profundas implicaciones para el tratamiento y prevención de enfermedades. Estrategias que promueven la formación de biofilm de Staphylococcus aureus han tenido éxito en modelos experimentales, los ensayos clínicos humanos para evaluar inhibidores en combinación con antibióticos bactericidas son una vía interesante de investigación futura. Aunque la administración oportuna de antibióticos sigue siendo el pilar del tratamiento de la enfermedad por N. meningitidis y las vacunas conjugadas de proteínas de polisacárido dominan la prevención, la aparición de resistencia a los antimicrobianos, las respuestas inconsistentes a las vacunas entre los niños, y una población mundial inmunocomprometida, se necesitan más enfoques complementarios. Los avances innovadores destinados a alterar la virulencia de N. meningitidis representan una estrategia sin explotar en la prevención de enfermedades en un huésped colonizado y la transmisión dentro de una comunidad.
Fuente bibliográfica
Dissemination of Neisseria meningitidis
Vincent Quagliarello, M.D.
Infectious Diseases Section, Department of Internal Medicine, Yale University School of Medicine, New Haven, CT.
N Engl J Med 2011; 364:1573-1575