Sortilina 1 y el riesgo de enfermedad coronaria
El verdadero poder de la investigación genómica se encuentra en su capacidad para ayudar a los científicos a comprender los procesos biológicos, en particular los que pueden conducir a una enfermedad. Esta facultad se ha demostrado recientemente en particular a la relación genética y biológica entre el colesterol y la enfermedad coronaria.
Por ejemplo, un equipo internacional de investigadores ha descrito diferentes variaciones genómicas que contribuyen a ciertos grados de alteraciones de colesterol en la sangre y de niveles de triglicéridos en múltiples poblaciones humanas. Además, se ha observado que una de estas variantes no sólo revela la participación de una vía genética en el metabolismo lipídico, sino también permite desentrañar las conexiones biológicas entre los niveles de lípidos y la enfermedad cardíaca coronaria. Si bien las concentraciones sanguíneas de colesterol y triglicéridos son importantes factores de riesgo para la enfermedad cardiovascular, el grado en que la genética contribuye y cómo las alteraciones en los genes conducen al desarrollo de la condición ha sido increíblemente difícil de reconstruir.
Colesterol y enfermedad de las arterias coronarias
Un estudio de asociación genómica publicado hace 3 años informó que la identificación de una variante de ADN en el cromosoma 1p13 aumentaba el riesgo relativo de enfermedad coronaria en un 29% por cada alelo. Unos meses más tarde, se encontró también que la misma variación genética - de nuevo a través de un enfoque de asociación genómica – era capaz de incrementar los niveles séricos de la lipoproteína de baja densidad (LDL). En ese momento, poco se sabía acerca de los genes en el locus 1p13, por lo que la relación funcional entre tal variante y el aumento de colesterol LDL y el riesgo coronario era desconcertante. Una investigación llevada a cabo por Kiran Musunuru y colaboradores (Nature 2010; 466:714-719) arroja luz sobre las vías subyacentes e identifica una nueva diana para la prevención y el tratamiento de la aterosclerosis.
Usando el alelo identificado previamente como ancla, los autores exploraron primero si existía relación entre la variante y la expresión de algunos de los genes del cromosoma 1p13. Este enfoque se basó en la hipótesis que la variante de riesgo puede alterar la presencia de una proteína crítica para el mecanismo patogénico (es decir, un “punto de apoyo” entre el alelo de riesgo y el fenotipo de la enfermedad). De hecho, los investigadores demostraron que específicamente en el hígado, un órgano íntimamente implicado en el metabolismo lipídico, tres genes en 1p13 se expresaban de forma reducida en los portadores del alelo de riesgo.
La modulación de múltiples genes por el alelo de riesgo sugiere la participación de un elemento regulador. Para encontrar este factor, los investigadores secuenciaron la región 1p13. Ellos encontraron variantes adicionales de ADN y posteriormente la probaron para la asociación con el colesterol LDL, un enfoque llamado mapeo fino. Además, redujeron la región que contiene la variante de la probable causalidad a un pequeño segmento. El análisis bioinformático indicó que una de las variantes (rs12740374) dentro de este segmento codificante se encontraba dentro de un supuesto sitio de unión para la proteína de unión al potenciador CCAAT (C/EBP), un factor de transcripción y alelo de riesgo que presumiblemente interrumpe la unión. Entonces, se especuló que este polimorfismo de un solo nucleótido (SNP) está directamente implicado en la regulación de la expresión génica en el cromosoma 1p13. De hecho, los investigadores confirmaron la unión física de C/EBP a un pequeño tramo de ADN que contiene la variante de protección, pero no la variante de riesgo rs12740374. Luego, observaron el incremento en la expresión de un gen en las células hepáticas transfectadas con un vector que no llevaba la variante C/EBP. Los experimentos sugirieron una cadena de eventos que ligan específicamente la variante de riesgo rs12740374 con menores niveles de expresión génica en el cromosoma 1p13 (figura 1).
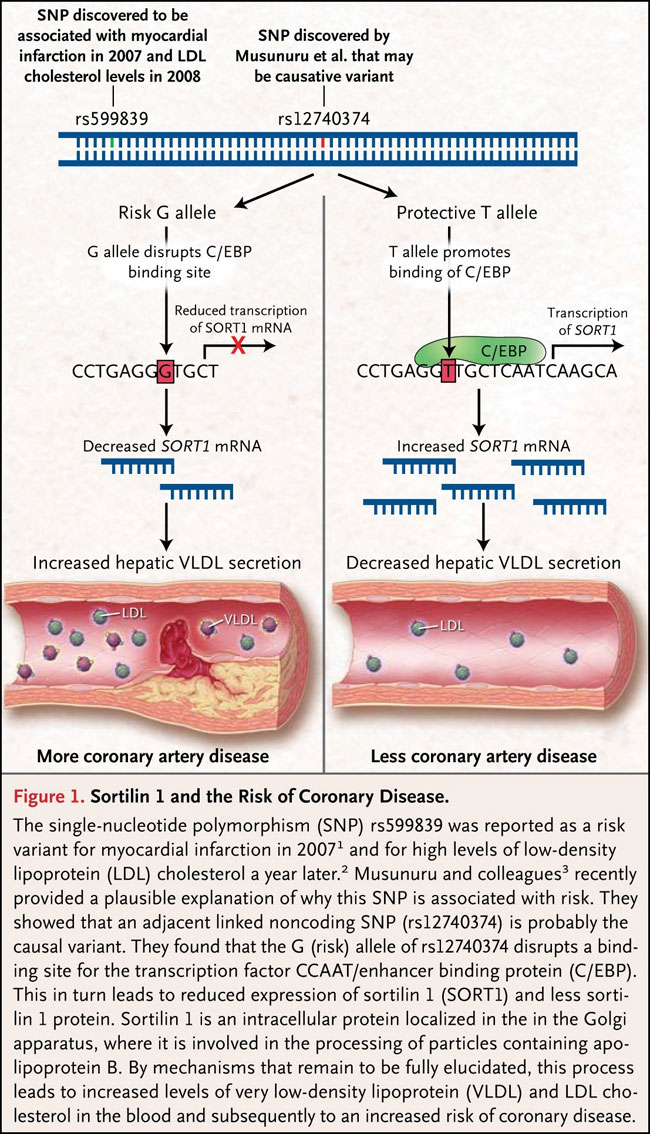
El 2007 y 2008 se informó que el polimorfismo de nucleótido único (SNP) rs599839 sería una variante de riesgo para el infarto de miocardio y los altos niveles de lipoproteína de baja densidad (LDL). Kiran Musunuru y colegas recientemente explicaron por qué este SNP estaría relacionado con el riesgo. Ellos demostraron que un SNP adyacente no codificante (rs12740374) es probablemente la variante causal. Encontraron que el alelo G (riesgo) rs12740374 interrumpe un sitio de unión para el factor de transcripción de la proteína de unión al potenciador CCAAT (C/EBP). Esto a su vez conduce a la expresión reducida de sortilina 1 (SORT1) y a una menor concentración de la proteína sortilina 1. Ésta es una proteína intracelular localizada en el aparato de Golgi, donde participa en la transformación de las partículas que contienen apolipoproteína B. Por mecanismos que aún se desconocen, este proceso conduce a mayores niveles de lipoproteínas de muy baja densidad (VLDL) y de colesterol LDL en la sangre y, posteriormente, a un mayor riesgo de enfermedad coronaria.
El gen más afectado en su expresión fue SORT1, que codifica la producción de la proteína sortilina. En consecuencia, el grupo de K. Musunuru evaluó su participación en el metabolismo del colesterol LDL. La sobreexpresión hepática de SORT1 en ratones disminuyó los niveles séricos de colesterol LDL. Su inhibición, presentó el efecto contrario, de tal modo que se imitó la situación en personas que llevan la variante de riesgo de rs12740374. Estos datos sugieren fuertemente que el SNP rs12740374 afecta la expresión de sortilina 1 y por lo tanto, es el responsable de la asociación entre las variantes en el cromosoma 1p13 y el colesterol LDL y, por extensión, del riesgo de enfermedad coronaria.
La interrogante es cómo el aumento de expresión de sortilina 1 conduce a los niveles séricos reducidos de colesterol LDL. La sortilina 1 se localiza en el aparato de Golgi y el retículo endoplasmático, donde parece actuar como un receptor intracelular de clasificación de las partículas que contienen apolipoproteína B. La investigación de K. Musunuru encontró que los hepatocitos en ratones con menos sortilina tienen un aumento significativo de la secreción de partículas que contienen apolipoproteína B, en particular colesterol de muy baja densidad (VLDL), mientras que la sobre-expresión se asoció con una disminución de dichas partículas (figura 1). Por otra parte, la sobre-expresión de sortilina 1 demostró mejorar la endocitosis de partículas de LDL in vitro. En conjunto, estos hallazgos proporcionan una fuerte evidencia experimental de la participación de la sortilina 1 en el metabolismo hepático de las lipoproteínas que contienen apolipoproteína B, aunque el mecanismo exacto espera aclaración.
La aparición de la variante de riesgo rs12740374 en múltiples poblaciones de diferente origen y su alta prevalencia (68% en los de ascendencia europea) señalan que este SNP afecta los niveles de las lipoproteínas de todo el mundo a través de sus efectos moduladores de transcripción génica. La disminución resultante de la expresión de sortilina parece elevar los niveles de dos lipoproteínas aterogénicas, VLDL y LDL, y por lo tanto actúa como una espada de doble filo respecto al riesgo de aterosclerosis. La importancia clínica de esta vía se define por un aumento sustancial en el peligro de enfermedad coronaria por cada copia del alelo de riesgo 1p13. Finalmente, el descubrimiento de la vía C/EBP-sortilina sustenta un ejemplo de cómo los estudios de asociación genómica pueden iniciar nuevos descubrimientos biológicos, lo que lleva a una mejor comprensión de la fisiopatología, que en última instancia podría traducirse en nuevos enfoques terapéuticos.
Fuente bibliográfica
Sorting Out Cholesterol and Coronary Artery Disease
Patrick Linsel-Nitschke, M.D., Nilesh J. Samani, M.D., M.B., Ch.B., and Heribert Schunkert, M.D.
Medizinische Klinik II, University of Lübeck, Lübeck, Germany (P.L.-N., H.S.); and the Department of Cardiovascular Sciences and Leicester National Institute for Health Research, Biomedical Research Unit in Cardiovascular Disease, University of Leicester, Leicester, United Kingdom (N.J.S.)
N Engl J Med 2010; 363:2462-2463


