Nefropatía lúpica y los basófilos
Para el clínico, el lupus eritematoso sistémico es una condición importante ya que potencialmente es fatal y se confunde fácilmente con muchos otros trastornos. Para el inmunólogo, el lupus es interesante porque todos los componentes claves del sistema inmunológico están involucrados en los mecanismos subyacentes de la enfermedad.
Su prevalencia varía desde unos 40 casos por 100.000 personas entre los europeos a más de 200 por cada 100.000 personas en la raza negra. En los Estados Unidos, la cantidad de pacientes supera los 250.000. La esperanza de vida ha mejorado de una tasa de supervivencia del 50% a 4 años en 1950 a una del 80% a 15 años en la actualidad. Aun así, un individuo diagnosticado a los 20 años de edad tiene una probabilidad de 1/6 de morir a los 35 años, a menudo por lupus o infección. Más tarde, el infarto de miocardio y el accidente cerebrovascular se convierten en causas importantes de muerte.
Las diversas presentaciones del lupus van desde el rash y la artritis hasta la anemia y desde trombocitopenia a la serositis, nefritis, convulsiones y psicosis. El lupus debe formar parte del diagnóstico diferencial en prácticamente cualquier paciente que presente uno de estos problemas clínicos, especialmente en aquellos de sexo femenino entre los 15 y 50 años de edad.
Basófilos y nefritis en el lupus eritematoso sistémico
El lupus eritematoso sistémico (LES) es una compleja enfermedad sistémica autoinmune que afecta principalmente a los riñones a la forma de nefritis lúpica, aunque también puede implicar a otros órganos. La nefritis lúpica se caracteriza por el depósito en los glomérulos de complejos inmunes formados por IgG, IgM, IgA y anticuerpos (que en conjunto se denominan anticuerpos antinucleares). Estos auto-anticuerpos se dirigen hacia los antígenos nucleares, sobre todo hacia la doble cadena de ADN. Su deposición puede resultar en la insuficiencia renal o incluso la muerte.
Son varios los mecanismos conocidos que contribuyen a la patogénesis de la nefritis lúpica, incluyendo los que son regulados por las células T helper tipo 1 (Th1) y tipo 17 (Th17). Aunque las respuestas humorales en forma de anticuerpos auto-reactivos (también conocidas como inmunoglobulinas) son mediadores efectores de la nefritis lúpica, y en algunos pacientes se ha observado la presencia de auto-anticuerpos IgE, no ha sido aclarada la forma en que las células T helper tipo 2 (Th2) y células B se activan en la patogenia de la nefritis lúpica.
Nicolas Charles y colegas (Nat Med. 2010 Jun; 16(6):701-7) dilucidan, en parte, esta interrogante a través de experimentos con ratones mediante células B "hiperactivas". En concreto, Lyn, una proteína tirosina quinasa que regula negativamente la activación de células B, está ausente en estos animales, y la enfermedad autoinmune se desarrolla de forma espontánea y tardía (a los 32 a 40 semanas). La condición comparte características con el LES: los ratones poseían anticuerpos contra la doble cadena de ADN, deposición de complejos inmunes en los glomérulos y daño renal. En experimentos adicionales con ratones tipo knock-out, el grupo de N. Charles concluyó que la nefritis era similar al lupus y producción de anticuerpos antinucleares e inmunoglobulinas anti-doble cadena de ADN en los animales deficientes para Lyn, dependientes de interleucina-4 e IgE (figura 1), lo que sugiere un papel para th2. Esta conclusión realza la participación de los basófilos y mastocitos, los principales tipos de células involucradas en la patogénesis dependiente de Th2. Los autores observaron que la deficiencia inducida por mastocitos en ratones deficientes para Lyn no modificaba el proceso autoinmune, mientras que la disminución de basófilos no reducía significativamente el número de IgG auto-reactivas circulantes, células plasmáticas del bazo y los niveles de mediadores proinflamatorios (como la interleucina-4) en los riñones.
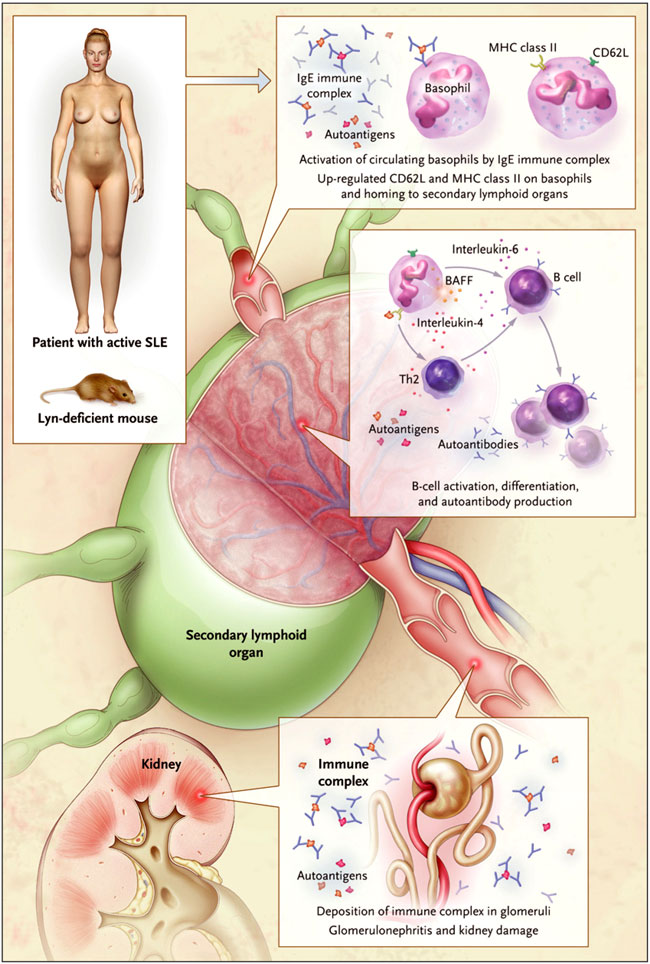
Análisis que permite el apoyo a un modelo para la patogénesis de la nefritis en el lupus eritematoso sistémico. Complejos inmunes con IgE, tanto en ratones con células B "hiperactivas" (ratones con deficiencia de Lyn) como en personas con LES, activan los basófilos circulantes que a su vez expresan un receptor linfoide secundario (CD62L, también conocido como L-selectina) y una molécula presentación de antígeno, el complejo mayor de histocompatibilidad (MHC) clase II. En órganos linfoides secundarios, estos basófilos activados secretan interleuquina-4 y promueven la diferenciación de las células T helper tipo 2 (Th2). Las unidades Th2 - en cooperación con la interleucina-6 derivada de basófilos y el factor BAFF - incrementan la diferenciación de células B y la supervivencia y producción de anticuerpos auto-reactivos. Los complejos inmunes de los cuales estos anticuerpos auto-reactivos son parte se depositan en los glomérulos y provocan nefritis lúpica.
Entonces, ¿cómo promueven la nefritis lúpica los basófilos? Los basófilos expresan FcεRI (un receptor de alta afinidad para los anticuerpos IgE), su unión (por el complejo inmune IgE) lleva a la activación de los basófilos. Este estudio determinó que los ratones deficientes en Lyn poseían IgE auto-reactivas y complejos inmunes IgE en la circulación, mediando por tanto la activación de basófilos y su recalada en órganos linfoides secundarios. A través de la secreción de interleucina-4 en estos órganos, los basófilos promueven la diferenciación Th2 (figura 1). Las células Th2, en cooperación con la interleucina-6 y el factor activador de células B (ligado a la membrana plasmática de los basófilos), incrementan la diferenciación de células B y la supervivencia y producción de anticuerpos auto-reactivos. Los complejos inmunes formados por estos anticuerpos auto-reactivos se depositan en los glomérulos y causan la nefritis lúpica. De acuerdo con este modelo, se da la observación de N. Charles y colaboradores que, similar a los ratones con deficiencia de Lyn, las personas con LES activo presentan niveles elevados de anticuerpos anti-ADN de doble cadena IgE y de basófilos activados en ganglios linfáticos y bazo.
En conjunto, estos resultados sugieren que los basófilos, la interleucina-4 y la IgE, participan en la patogénesis de la glomerulonefritis, promoviendo a Th2 y la activación de células B auto-reactivas. Sin embargo, los autores no determinaron cómo los basófilos se activan en la primera fase de exacerbación de la enfermedad en ausencia de IgE auto-reactivas.
¿Estos hallazgos cómo amplían nuestro conocimiento de la patogenia de la nefritis lúpica? ¿Cuáles son sus limitaciones? Los auto-anticuerpos IgE se detectan en aproximadamente el 30% de los pacientes con LES, por lo que es poco probable que ratones deficientes en Lyn sirvan de modelo en la mayoría de las personas afectadas. Este estudio plantea la interrogante de si los pacientes deberían ser clasificados de acuerdo a sus subgrupos Th y en consecuencia elaborar un enfoque terapéutico. Las células Th1 y Th17 también han sido implicadas en la patogenia de la nefritis lúpica en animales y humanos. Además, el fenotipo de la nefritis varía en función del subgrupo Th que se trate: una respuesta Th1 se asocia con la nefritis lúpica proliferativa difusa, mientras que una respuesta Th2 se asocia con la nefritis lúpica membranosa.
Un estudio de los genes (como IL4) que controlan las funciones de Th2 y de los basófilos podría fortalecer aún más estas observaciones y, posiblemente, dilucidar las razones de la gravedad del LES en ciertas poblaciones, como en las personas de raza negra. Esta investigación carece de una prueba de la función del interferón tipo I, una citoquina clave en la patogenia de la enfermedad.
Los ensayos clínicos han demostrado una incierta eficacia de las terapias dirigidas a las células B así como las de anti-anticuerpos monoclonales CD20 (rituximab), posiblemente por la heterogeneidad de la patogénesis. Además, estudios de fase 2 y 3 en personas con LES generalizada han indicado la eficacia clínica de los anticuerpos (belimumab) en contra el activador de células B (también conocido como estimulador de linfocitos B, o BLyS). Los resultados reportados por N. Charles y colegas sugieren que, además de afectar a las células B, belimumab puede impactar mediante la reducción de los basófilos. Por tanto, es posible que rituximab o belimumab, en combinación con los tratamientos que suprimen la producción de IgE o activación y la recalada de los basófilos a los ganglios linfáticos y el bazo, puedan beneficiar a algunas personas con nefritis lúpica.
Fuente bibliográfica
Basophils and Nephritis in Lupus
Srini V. Kaveri, D.V.M., Ph.D., Luc Mouthon, M.D., Ph.D., and Jagadeesh Bayry, D.V.M., Ph.D.
Institut National de la Santé et de la Recherche Médicale, Centre de Recherche des Cordeliers, Université Pierre et Marie Curie, Paris
N Engl J Med 2010; 363(11):1080-1082