Dengue: lo bueno, lo malo y lo feo
El dengue es una enfermedad potencialmente fatal. Los cuatro serotipos (DEN-1 a DENV-4) del virus del dengue son los flavivirus más importantes transmitidos por artrópodos en términos de morbilidad y distribución geográfica. Hasta 100 millones de infecciones ocurren cada año, principalmente en zonas tropicales y subtropicales en donde los mosquitos vectores son abundantes. La infección con cualquiera de los serotipos puede ser asintomática o conducir al dengue clásico o a casos graves de fiebre hemorrágica y al síndrome de choque por dengue, condiciones cada vez más presentes en las zonas endémicas.
La inmunidad a un mismo serotipo (inmunidad homotípicoa) es de por vida, mientras que la inmunidad a serotipos diferentes (inmunidad heterotípica) tiene una duración de 2-3 meses, después, la infección con un virus de serotipo diferente es posible. La fiebre hemorrágica y el síndrome de choque ocurren a menudo en pacientes con infecciones secundarias, inmunidad heterotípica o en lactantes con inmunidad maternal transferida. La forma grave del dengue es causa importante de hospitalizaciones, y en niños, las tasas de mortalidad varían de 1% a 5%. A través de los años, ha sido un misterio para la medicina, difícil de descifrar, el por qué es mucho más peligroso infectarse por segunda vez. Resolver esta problemática, podría ser útil para el futuro diseño de una efectiva y segura vacuna contra la enfermedad.
Respuestas a la fiebre del dengue
El dengue es la afección por arbovirus más extendida a nivel mundial. La mayoría de los pacientes infectados cursan sólo una enfermedad leve o fiebre el dengue clásico, con síntomas de tipo gripal, dolor intenso de cabeza, articulaciones y musculares. Sin embargo, un pequeño porcentaje de pacientes - no más de medio millón de personas cada año – desarrollan formas potencialmente letales llamadas fiebre del dengue hemorrágico y síndrome de choque por dengue. Se sabe desde hace muchos años que anticuerpos dirigidos contra cualquiera de las dos proteínas de la superficie del virus del dengue (la proteína precursora de la membrana y la proteína de la envoltura) pueden neutralizar la infectividad y conferir protección, a pesar que la proteína de la envoltura es el antígeno protector más importante. Paradójicamente, los anticuerpos contra la proteína pueden incrementar la infectividad, en función de su especificidad y avidez, y la concentración vírica. Wanwisa Dejnirattisai y colaboradores (Science 2010; 328:745-748) informaron recientemente que después de una infección secundaria de dengue, una gran parte del repertorio de anticuerpos humanos está dirigido contra la proteína precursora de membrana de las partículas virales maduras. Esta observación pudiera ser importante para el desarrollo de vacunas contra la forma inactiva de la enfermedad.
De dos a tres millones de personas en climas tropicales y subtropicales están en riesgo de infección, y se estima que se producen 50 millones de infecciones cada año, sobre todo en zonas urbanas. Los cuatro serotipos del dengue son transmitidos por mosquitos y la propagación de los serotipos y vectores (mosquitos) ha llegado a más de 100 países, incluido Estados Unidos. El cuadro clínico es muy variable, en particular con la edad. Los niños pequeños podrían simplemente tener fiebre y erupción cutánea, mientras que el dengue clásico es más propenso a desarrollarse en niños mayores y adultos. Si la fiebre avanza a la condición hemorrágica en el momento de la desaparición de la fiebre, que generalmente se manifiesta como un síndrome de fuga capilar acompañada de trombocitopenia y anomalías en la coagulación y función hepática, potencialmente puede terminar en estado de shock, hemorragia y falla orgánica.
La inmunidad permanente contra el serotipo infectante (inmunidad homotípica) se adquiere por anticuerpos neutralizantes del virus. Los anticuerpos inducidos por un serotipo pueden generar una reacción cruzada con los otros serotipos (inmunidad heterotípica), pero los títulos neutralizantes heterotípicos decaen en el tiempo. Por debajo de un umbral determinado y en función de la especificidad de los anticuerpos, éstos no pueden neutralizar y se opsonizan, lo que ayuda a que el virus infecte a las células con receptores para la IgG. Este fenómeno, denominado "mejora dependiente de anticuerpos", aumenta el número de células infectadas y la carga vírica, generando una respuesta inflamatoria más pronunciada. También están en alto riesgo los niños que nacen de madres inmunes al dengue y que, por tanto, tienen IgG neutralizantes de origen materno. Estas IgG protegen, durante varios meses, pero disminuyen y los niños entran en un período de mayor peligro para forma hemorrágica tras la infección primaria.
El grupo de W. Dejnirattisai generó un panel de anticuerpos monoclonales humanos contra el virus del dengue a partir de células B obtenidas de personas que habían padecido recientemente una infección secundaria. Más de la mitad de los anticuerpos monoclonales dirigidos contra las proteínas estructurales reaccionaron con la proteína precursora de membrana, y menos de la mitad reaccionaron con la proteína de la envoltura. La mayoría de estos anticuerpos monoclonales presentaron reactividad cruzada entre los serotipos. Los anticuerpos monoclonales contra la anti-proteína precursor de membrana, en general, eran menos propensos que los anticuerpos monoclonales anti-envoltura para neutralizar por completo el virus infeccioso, incluso en altas concentraciones y con independencia del serotipo examinado. Varios anticuerpos monoclonales contra la anti-proteína precursor de membrana neutralizaron no más de la mitad de los virus infecciosos, sugiriendo que al menos dos poblaciones de viriones pueden coexistir: una que es susceptible a la proteína precursora de la membrana y otra que no lo es. Como se ha descrito para determinados anticuerpos anti-envoltura, todos los anticuerpos monoclonales contra el anti-precursor de membrana fueron capaces de mediar la mejora dependiente de anticuerpos.
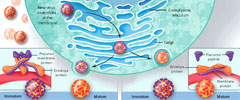
El conocimiento de la biología estructural y la inmunogenicidad del flavivirus han permitido comprender la interacción entre la maduración del virus, la infectividad y la unión de anticuerpos. La morfogénesis viral se inicia en el retículo endoplasmático, donde los viriones inmaduros brotan. Tres pares de proteínas del precursor de membrana y proteínas de la envoltura forman extensiones que sobresalen de la envoltura del virus en esta primera etapa (figura 1). La proteína precursora de membrana se asocia con la proteína de la envoltura y cubre un dominio en la proteína de envoltura (bucle de fusión) que media la fusión de la envoltura del virus con las membranas celulares a un pH bajo. La proteína precursora de membrana por lo tanto evita la activación prematura de la proteína de la envoltura. A medida que el virión madura en la red trans-Golgi, el precursor de membrana y la proteína de la envoltura trimérica se reordenan en dímeros, suprimiendo las puntas y suavizando la superficie del virus. Una proteasa celular rompe el péptido precursor de la proteína de membrana, y una vez que el virión brota de la superficie celular, el péptido precursor es liberado, el dominio de fusión de la proteína de la envoltura es desenmascarado, y el virus está listo para infectar. Sin embargo, el procesamiento de la proteína precursora de membrana hacia la proteína de membrana madura no siempre es eficiente, y el precursor inmaduro o parcialmente maduro disminuye la efectividad de los virus (figura 1).
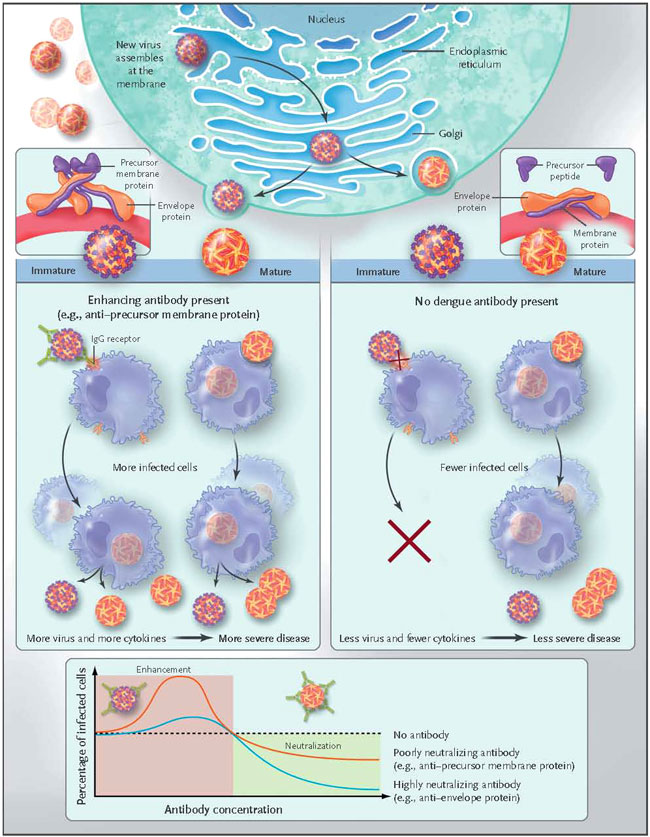
Análisis de un grupo de anticuerpos monoclonales a partir de células B aisladas de pacientes después de la infección secundaria del dengue. Aunque la mayoría de los anticuerpos monoclonales contra la proteína anti-envoltura neutralizan la efectividad del virus del dengue, la mayoría de los anticuerpos monoclonales contra la anti-proteína precursora de membrana no lo hace. El antígeno precursor de membrana es abundante en viriones inmaduros y no infecciosos, pero la proteína disminuye a medida que el virión madura y se convierte en infeccioso. Los virus maduros también pueden infectar células mononucleares a través de la endocitosis mediada por clatrina. Sin embargo, en presencia de anticuerpos anti-proteína precursora de membrana no neutralizantes, el virus aún inmaduro y no infeccioso puede entrar en las células que poseen receptores de IgG y replicarse de manera eficiente, dando lugar a más células infectadas, que luego producirán más virus y más citoquinas, que posiblemente contribuirán a una enfermedad más grave. Aunque los anticuerpos monoclonales contra la proteína de la envoltura y la proteína precursora de membrana, y por lo tanto, el suero policlonal, pueden aumentar la infección en bajas concentraciones, la anti-proteína precursora de membrana podría probablemente mejorar la enfermedad.
La inhibición de la escisión de la proteína precursora de membrana dio lugar a preparados con virus del dengue en su mayoría inmaduros y partículas no infecciosas. Sin embargo, los anticuerpos monoclonales anti-precursor de membrana fueron capaces de aumentar la infectividad de los viriones inmaduros así como fomentar su entrada en células con receptores de IgG, donde podrían ser activados una vez dentro. Los resultados reportados por la investigación de W. Dejnirattisai y colegas sugieren que poblaciones de virus funcionalmente diferentes coexisten: una población con una alta densidad de proteína precursora de membrana que es inmadura y no infecciosa, una con densidad intermedia de proteína precursora de membrana que es contagiosa, pero puede ser neutralizada por los anti-precursores de membrana (o anticuerpos contra proteínas anti-envoltura) y, finalmente, una población de viriones maduros que no pueden ser neutralizados por anticuerpos anti-proteína precursora de membrana, sin embargo, pueden ser neutralizados por anticuerpos anti-envoltura.
Se ha avanzado mucho en la comprensión del dengue, un pequeño modelo animal para la fiebre hemorrágica está disponible, y prometedoras vacunas están en desarrollo. Aunque todavía queda mucho trabajo por delante para comprender la inmunidad y la patogénesis de la enfermedad infecciosa, también hay motivos para el optimismo. El presente estudio sugiere un papel de las partículas inmaduras del virus en la infección secundaria en la que se convierten en infecciosas en presencia de anticuerpos no neutralizantes, lo que contribuye al desarrollo de la fiebre hemorrágica. Los autores sugieren, por ejemplo, que para ello puede ser conveniente diseñar vacunas que minimicen la respuesta del anti-proteína precursora de la membrana - mediante la generación de virus con proteínas de la envoltura del dengue y proteínas precursoras de membrana no-dengue. Sin embargo, se desconoce si tales quimeras serían viables. Más importante aún, los fabricantes de la vacuna necesitan garantizar que las vacunas tetravalentes de dengue induzcan una fuerte y duradera respuesta de los anticuerpos neutralizantes contra los cuatro serotipos, confiando probablemente en gran medida en la proteína de la cubierta como el antígeno protector. Mientras tanto, son necesarios nuevos estudios clínicos que caractericen la respuesta inmune e inflamatoria en el momento de la infección secundaria para comprender mejor las correlaciones y las causas de la enfermedad.
Fuente bibliográfica
Response to Dengue Fever — The Good, the Bad, and the Ugly?
Alexander C. Schmidt, M.D., Ph.D.
Laboratory of Infectious Diseases, National Institute of Allergy and Infectious Diseases, National Institutes of Health, Bethesda, MD.
N Engl J Med 2010; 363:484-487