Leucemogénesis, no sólo mutaciones genéticas
Las leucemias agudas se caracterizan por aberraciones cromosómicas recurrentes y mutaciones genéticas que son cruciales para la patogénesis de la enfermedad. Ahora es evidente que las modificaciones epigenéticas (fenómenos que no afectan la secuencia de ADN de los genes pero que sí varían su expresión), como la metilación del ADN y las modificaciones de las histonas, contribuyen sustancialmente al fenotipo de las células leucémicas.
Un problema adicional en la complejidad epigenética de la condición es el resultado patogénico de los micro-ARN y las vías de señalización molecular, y sus importantes efectos en la regulación transcripcional de los genes supresores de tumor y oncogenes. La heterogeneidad genética de las leucemias agudas plantea desafíos terapéuticos, pero los agentes farmacológicos dirigidos específicamente hacia los constituyentes de la máquina epigenética son prometedores como componentes del arsenal terapéutico para este grupo de afecciones.
Leucemia mieloide aguda y la vía de Wnt
La leucemia mieloide aguda (LMA) en adultos comprende un grupo heterogéneo de cánceres con diversas causas genéticas. Se cree que esta diversidad es la base de su variabilidad clínica y las respuestas a los regímenes quimioterapéuticos típicos. Sin embargo, a pesar de los notables progresos en la naturaleza de estas alteraciones genéticas y mejor comprensión de las consecuencias biológicas, no se han desarrollado terapias más eficaces.
A pesar de las diferencias genéticas entre clones de pacientes individuales, la mayoría tiene características comunes. Una de ellas es la gran perturbación o detención de los programas internos que normalmente operan en los precursores de las células sanguíneas para asegurar la adecuada diferenciación y muerte final. Otra es la adquisición de mecanismos que permiten a las células malignas poseer cierta capacidad proliferativa para ignorar, al menos parcialmente, las señales externas que limitan el número total de células producidas por las células sanguíneas normales. Estas dos características posibilitan la generación de clones leucémicos caracterizados por una gran acumulación de blastos (células sanguíneas inmaduras) no funcionales semejantes a las células primitivas, pero sin, de hecho, la capacidad de división.
Sin embargo, en la mayoría de los pacientes con LMA, engañosamente homogénea, la morfología indiferenciada de los blastos enmascara a un conjunto heterogéneo de células que recapitula la jerarquía de las células precursoras características del proceso de diferenciación de las células sanguíneas. En particular, sólo un pequeño subgrupo (< 1%) de blastos son capaces de un nuevo fraccionamiento, y un subgrupo aún más pequeño (< 0,01%) tiene la capacidad de causar leucemia después de ser inyectados intravenosamente en un modelo de ratón. El hecho que los elementos claves de la superficie celular y el transcriptoma de las células de la LMA posean esta habilidad de iniciar la enfermedad, similares a los atributos de las células madre de sangre normales, ha llevado al concepto que la propagación continua de ambos tipos celulares puede invocar mecanismos de desregulación muy parecidos.
El modelo más simple que describe cómo se desarrollan los clones de la LMA es que una célula madre de la sangre normal adquiere una secuencia de mutaciones (cambios epigenéticos) que altera la forma en su crecimiento controlado (e interferir la capacidad de su progenie para diferenciarse) (figura 1). Un segundo modelo es que las mutaciones que surgen de las células diferenciadas parcialmente restauran los patrones de expresión génica que permiten a estas células readquirir las propiedades únicas de auto-renovación provenientes de las células madre al mismo tiempo que interfieren con su posterior capacidad de diferenciarse. Ambos modelos plantean la emocionante posibilidad que los nuevos medicamentos sean capaces de bloquear directamente los principales sistemas de regulación en las células madre ofreciendo una terapia más eficaz. Sin embargo, no se ha identificado ninguna vía molecular en ningún de los dos modelos.
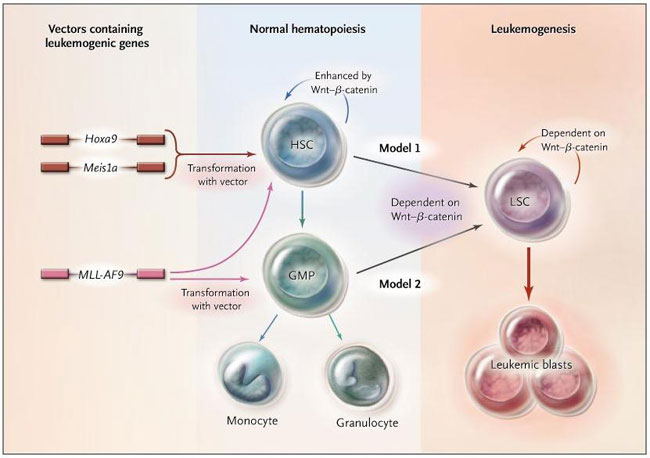
Jean C.Y. Wang y colegas descubrieron recientemente que la manipulación de la vía de señalización Wnt puede alterar la génesis de la leucemia derivada de células madre hematopoyéticas normales (HSCs) (modelo 1) o de progenitores de granulocitos y monocitos tardíos (GMPs) (modelo 2) transformados por ciertos vectores de genes leucémicos. La transformación hace que HSCs y GMPs adquieran propiedades de células madre leucémicas (LSCs). La vía de señalización Wnt-beta-catenina aumenta la auto-renovación de HSCs y es crítica para el desarrollo y auto-renovación de LSCs. Hoxa9 representa al gen homeobox A9, Meis1 al gen homeobox Meis, y MLL-AF9 al gen de la leucemia de linaje mixto.
Los genes Hox conforman una subconjunto de la familia homeobox y codifican los reguladores maestros de los programas de expresión génica, además, tienen un papel clave en el control de la auto-renovación de las células madre sanguíneas normales. La expresión de las proteínas HOX es alta en las células primitivas hematopoyéticas normales, pero luego disminuye notablemente después de la diferenciación celular. Por el contrario, en células humanas de LMA, la expresión de proteínas HOX a menudo se eleva, a veces por una mutación en algún gen HOX o, más frecuentemente, como consecuencia de alteraciones en las secuencias que regulan la expresión génica de Hox. En modelos de ratón, en la que el papel de las vías y genes específicos se puede evaluar con mucha precisión, se ha demostrado que el bloqueo, o la reactivación artificial de la expresión, de los correspondientes genes Hox y de cofactores celulares, puede inducir la aparición de nuevos clones leucémicos.
Siguiendo este enfoque, Wang y colaboradores manipularon genéticamente las leucemias en ratones mediante la sobreexpresión de un gen Hox y un gen que codifica un cofactor Hox (Meis1a) en células de médula ósea purificada de células madre y células progenitoras. A través de una cuidadosa labor de investigación sobre la expresión génica, los autores fueron capaces de deducir y, a continuación experimentalmente demostrar, que la transformación leucémica y el mantenimiento de la leucemia establecida en sus modelos depende de la activación de la vía beta-catenina - un componente clave de la cascada de señalización inducida por contacto con el factor de crecimiento Wnt (figura 1). Estos hallazgos son muy significativos ya que un medicamento que pueda orientar la vía de beta-catenina ofrecería un nuevo enfoque para el tratamiento de la LMA.
¿Cuáles son las advertencias de esta posibilidad para la LMA? Es evidente que los ratones y humanos difieren en tamaño, así como en algunos de los elementos que componen sus sistemas de regulación de tejidos. Así, aunque los mecanismos involucrados en la génesis y mantenimiento de la LMA humana sean los mismos, el mayor número de células leucémicas en el ser humano hace que en el momento del diagnóstico, el paciente portará células mutantes resistentes a cualquier nuevo medicamento. Y, aunque exista la disposición de un medicamento, sigue existiendo la preocupación que el proceso normal de la hematopoyesis también se vea perjudicado. Sin embargo, los resultados de esta investigación hacen presagiar alguna utilidad terapéutica, ya que estudios previos han indicado que la estabilidad normal de las células madre hematopoyéticas, una vez establecida en el ratón adulto normal, no depende de una señal funcional de Wnt-beta-catenina.
Fuente bibliográfica
Acute Myeloid Leukemia and the Wnt Pathway
Connie J. Eaves, Ph.D., and R. Keith Humphries, M.D., Ph.D.
Terry Fox Laboratory, British Columbia Cancer Agency, Vancouver, BC, Canada.
N Engl J Med. 2010 Jun 17; 362(24):2326-7