Inflamación: trágico malentendido
El trauma es la principal causa de muerte prematura. Las lesiones provocan la activación de los neutrofilos polimorfonucleares, falla orgánica, susceptibilidad a la infección y el síndrome de respuesta inflamatoria sistémica, condición generada principalmente por la activación del sistema inmunitario y una masiva reacción inflamatoria debido a la liberación sistémica de citocinas, en respuesta a diversos procesos patológicos de etiología tanto infecciosa como no infecciosa.
Por otra parte, se pensaba que la translocación bacteriana (paso de las bacterias y sus productos a través de la mucosa gastrointestinal, proceso que ayuda a explicar la aparente paradoja entre la no localización de un foco séptico y/o fallo multiorgánico) hacia la circulación causaba dicho síndrome. Esto ha sido refutado recientemente, si bien el shock puede provocar inflamación intestinal. Traumas y quemaduras, sin embargo, gatillan el síndrome de respuesta inflamatoria sistémica sin shock. Así, las señales moleculares que unen la injuria con la inflamación siguen siendo poco conocidas.
Mitocondrias, promotoras de la inflamación
Las amenazas a la integridad de un organismo pueden causar inflamación. La respuesta es altamente conservada y esencial: la desregulación defectuosa o la inflamación suelen ser incompatibles con la supervivencia. Sin embargo, son procesos muy arriesgados. Los leucocitos reclutados para combatir los microorganismos causan daños colaterales que a menudo son más graves que los generados originalmente por el patógeno. Por otra parte, la inflamación se produce incluso en pacientes con lesiones de tejidos estéril, como el trauma y la reperfusión isquémica.
El costo que los pacientes pagan por la inflamación en estas condiciones suele ser alto. El reciente estudio realizado por Qin Zhang y colegas (Nature 2010; 464:104-107) revela detalles sobre este interesante tema. En resumen, el sistema inmunitario reconoce la liberación mitocondrial del tejido dañado de la misma forma como las mitocondrias reconocen a las bacterias, y moviliza su potencial destructivo para limitar la proliferación y detener una invasión poco probable. Este trágico "malentendido" podría tener un papel en varias enfermedades humanas, que lleva a la inflamación en condiciones clínicamente tan diversas como el síndrome de respuesta inflamatoria sistémica, infarto de miocardio, isquemia cerebral y la autoinmunidad sistémica u orgánica.
El sistema inmune innato es muy eficaz en el reconocimiento de los patógenos. Esto se realiza mediante la identificación de "etiquetas" moleculares, conocidas como patrones moleculares asociados a patógenos, en donde se "marcan" a los microorganismos y no a las células huésped. Dada la enorme presión evolutiva, parece probable que estos patrones sean críticos en la capacidad del microbio para sobrevivir o infectar. Ejemplos de patrones moleculares asociados a patógenos son la formilmetionina y las proteínas bacterianas formiladas, que son sintetizadas por las bacterias y representan potentes estímulos para la atracción y activación de leucocitos. Del mismo modo, los dinucleótidos citosina-fosfato-guanina (CPG) no metilados son frecuentes en el ADN microbiano y provocan respuestas inflamatorias e inmuno-estimulantes.
Los receptores de reconocimiento de patrones dotan a las células inmunes - neutrófilos, macrófagos, células dendríticas y mastocitos - con la capacidad de reconocimiento microbiano; el receptor intracelular Toll-like 9 (TLR9), por ejemplo, identifica el ADN microbiano en el compartimiento de los endosomas. Los receptores de reconocimiento de patrones codificados en células germinales no son distribuidos como clones. Todas las células que expresan esto, de inmediato identifican a los patógenos como una potencial amenaza. Ellas inician la inflamación, secreción de citoquinas y quimioquinas, llamando la atención y atrayendo a otros leucocitos, focalizando su potencial destructivo en el sitio de la infección.
Las mitocondrias son organelos unidos a la membrana y producen energía en casi todas las células eucariotas. Se desarrollan a partir de alfa-proteobacterias endosimbiontes (un pariente de brucella y rickettsias). Las mitocondrias tienen su propio ADN, rico en secuencias CpG hipometiladas, las que se duplican cuando los orgánulos se dividen. El origen de la célula eucariota sigue siendo tema controvertido, y las formas de transición entre procariotas y eucariotas, no se han documentado convincentemente. La fusión de dos procariotas o de un procariota con una célula precursora eucariota son los escenarios más posibles. De todos modos, se entiende que la unión se produjo mucho antes que la existencia de un sistema inmune, que por definición, es una característica exclusiva de los organismos multicelulares.
El grupo de Q. Zhang explica que, en virtud de su origen evolutivo, las mitocondrias podrían ser reconocidas por los receptores de reconocimiento de patrones, por lo que podrían iniciar el proceso inflamatorio. Este evento parece poco probable que ocurra en tejidos sanos, en donde las mitocondrias unidas a la membrana están dentro de las células. Zhang y colaboradores detectaron ADN mitocondrial en la sangre de pacientes con síndrome de respuesta inflamatoria sistémica después de un trauma mayor, en concentración suficiente como para activar TLR9 y fosforilar la proteína quinasa p38 activada por mitógenos (una molécula de señalización en TLR9). Por otra parte, los investigadores observaron que las proteínas mitocondriales de los tejidos humanos estimulan el receptor formil péptido 1 en los neutrófilos, generando la producción de una colagenasa que mantiene la migración de leucocitos en los tejidos periféricos. La inyección intravenosa de proteínas mitocondriales en ratones dio lugar a la activación de neutrófilos circulantes, con extravasación a órganos periféricos como el hígado y el pulmón. Seguido, se desarrolló lesión pulmonar aguda, con producción del factor de necrosis tumoral alfa e interleucina-6 y la acumulación de proteínas y líquidos en el espacio alveolar (figura 1). Por el contrario, los neutrófilos perdieron la capacidad de responder a factores quimiotácticos, limitando su competencia para llegar a los sitios de infección, contribuyendo a la depresión inmunológica asociada al síndrome de respuesta inflamatoria sistémica.
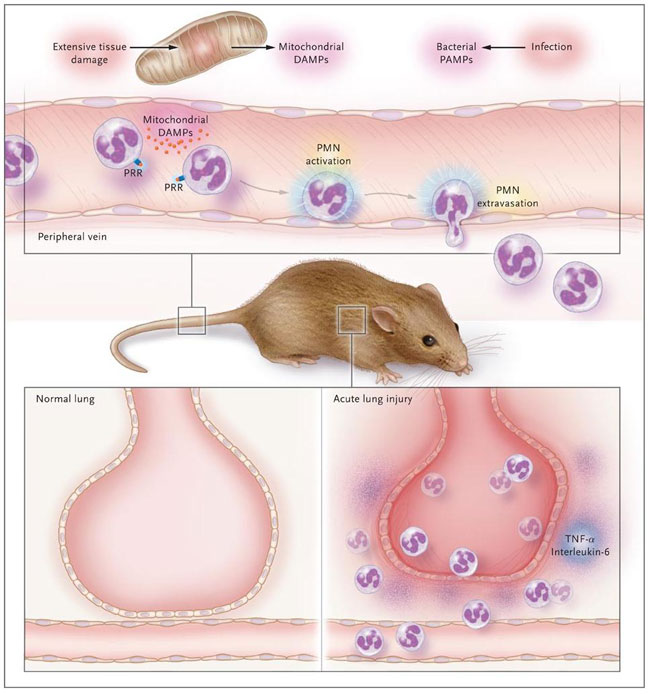
Las moléculas mitocondriales comparten varias características con las moléculas microbianas. Por ejemplo, las proteínas mitocondriales, como las proteínas bacterianas, son formiladas en su amino terminal. Q. Zhang y colegas observaron recientemente que la inyección por vía intravenosa de proteínas formiladas mitocondriales en ratones activa los neutrófilos en la sangre, lo que lleva a su extravasación y migración hacia órganos periféricos. Las secuelas son las principales características de la lesión pulmonar aguda, como la liberación de proteasas y otras fracciones tóxicas que dañan los vasos endoteliales, con pérdida de la función de barrera y edema. DAMP: patrón molecular asociado al daño, PAMP: patrón molecular asociado a patógenos, PMN: células polimorfonucleares, PRR: receptor de reconocimiento de patrones, y TNF-alfa: factor de necrosis tumoral alfa.
El estudio realizado por Q. Zhang y colegas proporciona nuevas pistas sobre el síndrome de respuesta inflamatoria sistémica en pacientes con traumatismos graves, una condición que en gran medida hasta ahora ha sido inexplicable. Las interrogantes permanecen. Mecanismos moleculares distintos de los descritos por la investigación pueden estar implicados en la acción inflamatoria de las moléculas mitocondriales. Por ejemplo, los componentes mitocondriales activan selectivamente un inflamasoma que regula el manejo y la producción de interleucina-1 e interleucina-18. Esta observación sugiere una posible relación con otras condiciones inflamatorias, como las autoinflamatorias. Por otra parte, señales adicionales (o patrones moleculares asociados al daño) generadas por la muerte celular tienen un potencial inflamatorio. Las estructuras mitocondriales liberadas por las células lesionadas, posiblemente gatillan la inflamación durante la lesión cardíaca, en los riñones o la isquemia cerebral, en la que la activación de neutrófilos locales se produce cuando el flujo sanguíneo se restaura. Por último, las mitocondrias son probablemente liberadas en pacientes con enfermedades infecciosas - en los que la muerte celular tiene lugar - contribuyendo posiblemente a la patología molecular de la sepsis. Finalmente, la identificación de las mitocondrias, como promotoras de la inflamación puede dar lugar a nuevos e intrigantes fármacos.
Fuente bibliográfica
The Mitochondrion — A Trojan Horse That Kicks Off Inflammation?
Angelo A. Manfredi, M.D., and Patrizia Rovere-Querini, M.D., Ph.D.
Istituto Scientifico San Raffaele and Università Vita-Salute San Raffaele, Milan, Italy.
N Engl J Med. 2010 Jun 3; 362(22):2132-4