Cuando BRCA1 no aparece
Las causas genéticas del cáncer han dominado la investigación en los últimos años. Pero, además de las mutaciones en genes, cada vez es más evidente que el cáncer es también epigenético, una enfermedad de la regulación de los genes y de su expresión, de la metilación del ADN y sus promotores.
No se sabe exactamente qué causa el cáncer de mama pero existen ciertos factores de riesgo que parecen aumentar la probabilidad que a una mujer se enferme. Se estima que cerca del 10% de los casos son hereditarios; es decir que se pasan de generación en generación. Por ejemplo, se sabe que mutaciones en el gen supresor de tumores BRCA1 (siglas en inglés para breast cancer 1) se asocian con un riesgo elevado de cáncer de mama y de ovario. Las proteínas BRCA1, que regulan el ciclo celular y evitan la proliferación incontrolada, participan directamente en la respuesta al daño del ADN y actúan como ligasas de ubiquitina. Sin embargo, su regulación sigue siendo poco conocida.
Controlando el tráfico de BRCA1
Más de 200.000 mujeres en los Estados Unidos llevan una versión anormal del gen BRCA1 que conduce a un mayor riesgo de cáncer de mama, por lo tanto, descubrir cómo las mutaciones en este gen promueven dicha enfermedad es una tarea importante. Como la proteína BRCA1 ayuda a reparar el ADN dañado, las preguntas claves se basan en entender de qué manera los genes BRCA1 localizan los sitios de daño en el ADN para que se pueda llevar a cabo la reparación y cómo ciertas mutaciones impiden la localización. Estudios recientes realizados por Joanna R. Morris, y colaboradores (Nature 2009; 462:886-890) y Yaron Galanty y colaboradores (Nature 2009; 462:935-939) han implicado a las proteínas modificadoras tipo ubiquitina de pequeño tamaño (SUMO) en el transporte de BRCA1 hacia las roturas del ADN.
Después del quiebre de la doble cadena en el ADN, varios complejos de proteínas - incluyendo las moléculas MRN, ATM y gamma-H2AX - llegan a la escena. Este último tiene una cola que cuando es fosforilada se une a MDC1 (mediador de la proteína 1 del punto de verificación de daños del ADN). Esta unión trae refuerzos, como la proteína RNF8 y otras unidades similares, que permiten integrar a BRCA1 (figura 1).
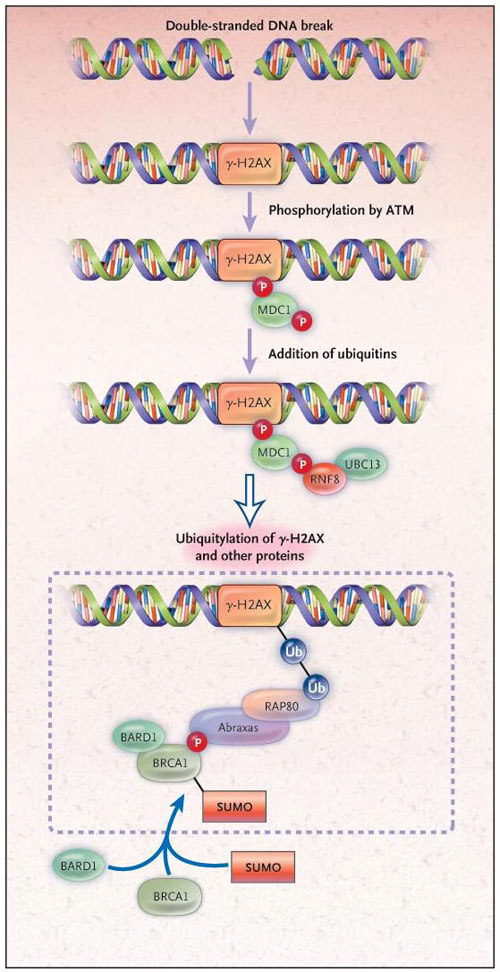
Algunos de los procesos que siguen a una doble ruptura en la cadena de ADN. En la parte superior de la figura, varios complejos de proteínas - incluyendo moléculas como gamma-H2AX, ATM y MDC1 - son dirigidos al sitio dañado, donde se produce la fosforilación (P). Después de la adición de la ubiquitina ligasa RNF8 y UBC19, continúa la ubiquitinación generalizada (Ub) de gamma-H2AX y otras proteínas. Esto atrae a RAP80, que contiene un sitio de interacción para la ubiquitina, y a través del complejo Abraxas fosforilado (también llamado ABRA1 o CCDC98), BRCA1 es llevado a la escena. Todo el complejo está indicado en el cuadro de líneas discontinuas. Un estudio reciente de Joanna R. Morris y colegas sugiere que BRCA1 se une covalentemente a las proteínas modificadoras tipo ubiquitina de pequeño tamaño (SUMO) a través de las cadenas laterales de lisina. Las investigaciones de Morris y Galanty encontraron que ligasas SUMO son esenciales para la localización de BRCA1 en los sitios dañados del ADN y que BRCA1 se sumoiliza así misma, junto con BARD1, actuando como ligasa ubiquitina E3 y generando también la ubiquitinación de proteínas locales. Estos resultados enfatizan las complejas relaciones entre la ubiquitinación, sumoilación, y la respuesta para reparar el ADN dañado.
Para entender más las cosas, hay que conocer el proceso de ubiquitinación proteica. Las ubiquitinas comprenden una familia de pequeñas proteínas que controlan la actividad de otras proteínas más grandes mediante su marcaje - ya sea para su destrucción por el proteosoma o para el transporte a los diferentes compartimentos celulares. Este proceso de marcado implica una cascada compuesta de tres enzimas, conocidas como E1, E2 y E3. La enzima E1 activa la ubiquitina y luego la transfiere a E2, que interactúa con la E3 para mediar en la transferencia de la molécula de ubiquitina a la proteína diana. Hay cientos de ubiquitinas E3, cada uno de ellas (con un poco de ayuda de la conjugación de varias enzimas E2) selecciona la proteína específica que recibirá una etiqueta de ubiquitina, lo que determinará el destino - proteasoma o el núcleo - de las moléculas específicas. Una clase importante de ligasas de ubiquitina E3 es el grupo de proteínas RING (realmente interesante nuevo gen). Estas actúan como andamios que yuxtaponen la proteína diana y la enzima catalítica ubiquitina E2.
Ambas RNF8 y BRCA1 son ligasas de ubiquitina E3 en el grupo RING. La actividad de la ligasa E3 para BRCA1 aumenta considerablemente por una interacción física directa entre los genes BRCA1 y su pareja BARD1 (que también tiene un dominio RING). Estas observaciones, sin embargo, constituyen sólo pruebas circunstanciales que sugieren un papel importante de la ubiquitinación dependiente de BRCA1 en la reparación del daño en el ADN. Como resultado, existen más proteínas de etiquetado y no sólo la simple ubiquitinación. De hecho, hay otro proceso distinto - análogo a la ubiquitinación - que permite la realización de la ubiquitinación. Este mecanismo central con proteasas similares a la ubiquitina es conocido como SUMO. Miembros de SUMO, cuando se unen covalentemente a las proteínas a través de las cadenas laterales de lisina (proceso de modificación post-traduccional llamado sumoilación), remodelan la superficie de estas proteínas, lo que afecta las funciones de tres maneras principales: a través de la inhibición de la interacción normal entre el objetivo de la sumoilación y otra proteína, mediante el suministro de una superficie vinculante, y por medio de cambios conformacionales en la proteína diana.
Joanna R. Morris y colaboradores encontraron que las proteínas SUMO co-localizan, en conjunto con gamma-H2AX y BRCA1, los sitios de daño genotóxico causados por la irradiación, el cisplatino y la hidroxiurea. Los autores finalmente identificaron a los genes BRCA1 como ligasas de ubiquitina reguladas por SUMO. El grupo de Y. Galanty destacó la amplia participación de SUMO en la reparación de roturas del ADN de doble cadena. Además, el agotamiento de BRCA1 suprime la acumulación proteica de estos sitios dañados, y a la inversa, el agotamiento de las ligasas SUMO reduce la acumulación de BRCA1 en los lugares de gamma-H2AX. Los autores sugieren que la sumoilación de BRCA1 es un evento clave en el transporte de los genes BRCA1 a los sitios dañados en el ADN y ayuda a mantener la proteína que hace su trabajo.
En los últimos años, varios estudios han demostrado que la sumoilación puede tener un papel causal en la enfermedad, por ejemplo, las proteínas que están implicadas en las enfermedades neurodegenerativas como Huntington, Alzheimer, Parkinson y Lou Gehrig son todas objetivos para la sumoilación. Por otra parte, proteínas relacionadas con el cáncer, como TP53, RB1 y MDM2, también son blanco de SUMO, y concentraciones elevadas de una determinada enzima SUMO se encuentran en algunos tipos de cáncer. Casi todas las vías de reparación del ADN están reguladas por la ubiquitinación y sumoilación. Uno podría imaginar que una inadecuada o equivocada modificación post-traduccional de proteínas por la sumoilación pueda ser un paso importante en la patogénesis de una amplia variedad de enfermedades humanas.
¿Puede la sumoilación convertirse en una ventaja terapéutica? Una medicina tradicional china, conocida como Ai-ling 1, contiene altos niveles de arsénico que induce la remisión de la leucemia promielocítica aguda. Esta acción parece estar provocada en parte por la sumoilación de la LMP y la LMP-RARalfa. Encontrar maneras de manipular específicamente la sumoilación puede influir sobre los enfoques para el tratamiento del cáncer y otras enfermedades comunes.
Fuente bibliográfica
Traffic Control for BRCA1
William D. Foulkes, M.B., B.S., Ph.D.
Program in Cancer Genetics, Department of Oncology, and the Lady Davis Institute, McGill University, Montreal.
N Engl J Med. 2010 Feb 25; 362(8):755-6