Los senderos de la longevidad
Se sabe que la rapamicina puede actuar como antibiótico y tener propiedades antifúngicas e inmunodepresoras. En la actualidad se utiliza como supresor del sistema inmunológico en personas con trasplantes y el manejo de algunos cánceres. TORm (blanco de la rapamicina en mamíferos) es fundamental en el catabolismo y anabolismo celular que determina si las células, y en particular las cancerígenas, deben crecer y proliferar, además, regula la apoptosis. La inhibición de TORm mediante intervención genética o farmacológica incrementa la vida en invertebrados, incluyendo la levadura, nematodos y la mosca de la fruta.
Estudios genéticos en Saccharomyces cerevisiae, Caenorhabditis elegans y Drosophila melanogaster han implicado a varios mecanismos en la regulación de la duración de la vida. Estos incluyen la insulina, el factor de crecimiento tipo insulina-1 (IGF-1) de señalización (IIS) y TORm, los cuales activan el efector de la proteína ribosomal S6 quinasa 1 (S6K1). El papel de estas vías en el envejecimiento de los mamíferos es menos claro, y no existe evidencia que IIS o la inhibición de la ruta mTOR regulen la duración de la vida en especies de animales vertebrados.
Control molecular de las patologías relacionadas con la edad
Prolongar una vida sana ha fascinado a la humanidad desde que Gilgamesh no pudo impedir la muerte de su amigo Enkidu cuando éste descendía a un horrible infierno, como se describe en el poema épico del antiguo Irak. Los recientes descubrimientos sobre el envejecimiento indican que la ciencia moderna está más preparada para mantener a raya la senectud - al menos temporalmente y hasta el momento sólo en gusanos, moscas y roedores - que detenerla por completo. Un reciente estudio de Colin Selman y colegas (Science 2009; 326:140-144) ha identificado la proteína ribosomal S6 quinasa 1 (S6K1) como un importante participe en el juego molecular del envejecimiento. Estos investigadores observaron que la supresión del gen S6k1 en ratones conduce a una mayor vida útil y resistencia a enfermedades relacionadas con la edad. En comparación con sus compañeros de camada tipo salvaje, los animales deficientes para S6k1 estaban protegidos contra alteraciones del sistema motor, óseo y función inmune (pero no contra el cáncer) y poseían una elevada sensibilidad a la insulina en la vejez.
Vías genéticas conservadas modulan la duración de la vida en organismos como la levadura, gusanos, moscas y ratones. Las más destacadas son las relacionadas con la insulina, la vía del factor de crecimiento tipo insulina-1 de señalización (IIS) y la vía objetivo de la rapamicina (ahora conocida como sirolimus, o TOR, siglas en inglés para target of rapamicina) (figura 1). La inhibición de estas vías se ha convertido en una de las formas más sólidas de longevidad entre las especies, por lo tanto, la identificación de sus etapas intermedias es fundamental para entender los mecanismos que subyacen y regulan la prolongación de la vida.
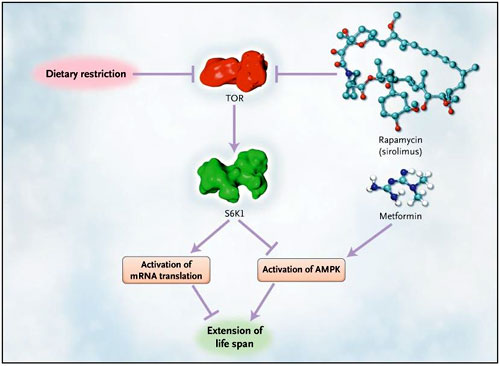
La proteína diana de la rapamicina (sirolimus) surge como un mediador de la duración de la vida a través de la restricción dietética en múltiples especies. Se ha demostrado que la inhibición de la quinasa S6 (S6K) prolonga la vida útil de las levaduras, moscas, gusanos y ahora en ratones (como se describe en la publicación de C. Selman y colaboradores). Las activaciones del ARN mensajero (ARNm) y de la AMP quinasa (AMPK) producen un “flujo o regulación descendiente” de la activación de S6K1, pasos críticos para fenotipos que tienen una vida prolongada. Los medicamentos dirigidos a TOR, como el sirolimus y metformina, alargan la vida de los ratones.
¿Cómo funciona la supresión de S6K1 para extender la vida? S6K1 aumenta la traducción del ARN mensajero durante períodos de alto crecimiento. Se trata de una “regulación descendiente” en la vía de TOR, que actúa para integrar los nutrientes y las señales de la insulina. Los gusanos y ratones que carecen de S6K1 crecen más lentamente que sus contrapartes silvestres, y el tamaño de su cuerpo se reduce. ¿Cómo se relaciona esto con el envejecimiento? Tal vez la merma de la síntesis proteica puede extender el tiempo de vida, posiblemente mediante la activación de los sistemas de defensa celular contra una variedad de agentes nocivos. En consonancia con esta hipótesis, existe la idea que el envejecimiento puede deberse a una acumulación de daños somáticos. Por otra parte, el aumento de las respuestas al estrés acompaña la extensión de la vida (en modelos animales) provocada por la inhibición de IIS o la actividad TOR. La mitigación del crecimiento podría conducir a un cambio hacia la mantención somática.
Una alternativa, favorecida por el trabajo del grupo de C. Selman, es que la extensión de la vida provocada por la caída de la actividad S6K1 se efectúa a través de la alteración del metabolismo energético. Se cree que esto es el mecanismo base de la prolongación de la vida por efecto de la restricción dietética en múltiples especies. La similitud entre el perfil de expresión genética del hígado en ratones S6k1-/- y los ratones sometidos a la restricción dietética es coherente con esta hipótesis. La mayor actividad de AMP quinasa (AMPK) en el hepatocito es otro "denominador común" para animales S6k1-/- y aquellos sometidos a restricción dietética. AMPK es un sensor del estado de energía y un objetivo “flujo descendiente” de la vía TOR (Figura 1). C. Selman y colegas también observaron la activación de AMPK en cepas de Caenorhabditis elegans deficientes en el ortólogo C. elegans S6k1. El uso de este nemátodo mutante permitió a los investigadores la obtención de pruebas de la activación de AMPK (en oposición a la traducción modificada) como el evento regulador fundamental en el efecto de S6k1 sobre la longevidad. En este sentido, cabe destacar que la metformina aumenta la activación de la AMPK y extiende la vida de los ratones hembras. Independientemente del mecanismo “flujo descendiente”, el efecto de la supresión de S6k1 en la longevidad de los ratones hembras es coherente con el efecto de la administración de sirolimus en ratones más viejos: el ciclo de vida se amplía en cada caso, aunque el resultado con sirolimus se observa en ambos sexos.
La actual ola de experimentos que demuestran de forma reproducible una extensión de la vida en ratones con modulación experimental de las vías conservadas ha ganado atención. La conservación de la vía TOR de las plantas a los seres humanos, así como el hecho que las drogas que apuntan a estas vías ya están en uso clínico, son un buen augurio para la intervención farmacológica del envejecimiento. Dicho esto, muchas cuestiones deben abordarse antes que se pueda contemplar un ensayo clínico de intervención de este tipo. No menos importante es el tema de los efectos a largo plazo de los medicamentos que apunten a la vía de TOR - drogas actualmente en uso (por ejemplo, sirolimus o metformina) o, eventualmente, a ser desarrolladas. También está el tema que el modelo de ratón, a nivel molecular, imita el proceso de envejecimiento en los seres humanos. El hecho que el cáncer desarrollado en ratones deficientes en S6k1 tenga la misma proporción que en los ratones control contrasta con el efecto terapéutico del sirolimus sobre el cáncer en seres humanos y remarca las diferencias de los mecanismos moleculares entre especies. También es curioso que la deficiencia de S6k1 tenga un efecto sexo-específico. ¿Cuál es su fundamento?
No obstante estas preguntas, se justifica seguir trabajando en este ámbito. La ampliación de una vida saludable probablemente conduciría a una reducción de los costos de atención en salud al proporcionar protección contra las enfermedades para las que el envejecimiento es un factor de riesgo.
Fuente bibliográfica
Aging — Lost in Translation?
Pankaj Kapahi, Ph.D., and Jan Vijg, Ph.D.
Buck Institute for Age Research, Novato, CA, USA.
N Engl J Med. 2009 Dec 31; 361(27):2669-70


