Terapia génica en colores
Ensayos de terapia genética se están realizando para la amaurosis congénita de Leber. Hasta ahora, el tratamiento ha sido aplicado en personas que han sufrido degeneración de la retina debido a la enfermedad. Los recientes experimentos han utilizado la terapia genética en primates para hacer frente a los trastornos de la visión en fotorreceptores que están intactos y sanos, permitiendo evaluar el potencial del procedimiento para restaurar la capacidad visual.
El tratamiento que permite a los monos ver nuevos colores en la edad adulta proporciona un ejemplo impresionante de lo que ocurre en condiciones de privación monocular. Por ejemplo, es imposible restaurar la visión en adultos que han crecido con una catarata unilateral. Las futuras tecnologías permitirán muchas oportunidades para adicionar o restaurar las funciones del ojo. Aunque algunos cambios producen resultados análogos a la privación monocular, otros, como la terapia génica para la ceguera del color amarillo-verde, podrán recuperar la visión previa.
Terapia génica y daltonismo
La incapacidad para distinguir las combinaciones de color, o "ceguera al color", es uno de las anomalías hereditarias más comunes y mejor entendidas, auto-diagnosticada por primera vez hace más de 200 años por el químico inglés John Dalton. En los Estados Unidos, se estima que 10 millones de hombres (aproximadamente el 7% de la población masculina) no pueden distinguir los colores verde y rojo, y el 8% de los hombres y el 1% de las mujeres tienen algún grado de daltonismo. Así, el reciente informe de Katherine Mancuso y colegas (Nature 2009; 461:784-787), que describe la corrección de tal déficit en dos monos ardilla, es de considerable interés.
La retina humana normal contiene dos clases de neuronas sensibles a la luz: los fotorreceptores bastones, que responden a los de luz tenue, y los fotorreceptores conos, que responden a la luz brillante, el segundo tipo fue el tema central del estudio realizado por Mancuso y colaboradores. La visión comienza con la absorción de luz por los pigmentos visuales en estas células. En los humanos, los conos llevan uno de los tres diferentes pigmentos presentes (opsinas). Estos son máximamente sensibles a diferentes longitudes de onda (longitudes de onda larga, media y corta, o roja, verde y azul, respectivamente), y las personas que tienen estos tres pigmentos son tricromatas. Combinados, el espectro de absorción de los tres pigmentos cubre el espectro visible.
Diferentes formas de daltonismo resultan de la pérdida o modificación de uno o más opsinas de los conos. La anomalía más frecuente es la pérdida de una opsina (por lo general, el pigmento que es sensible a la longitud de onda larga o media), y en esas personas, se genera la dicromacia. Superficialmente, los dicrómatas parecen tener una visión normal. Pueden tener agudeza visual de 20/20, con campos visuales completos, y sensibilidad normal a la luz blanca. Sin embargo, tienen dificultad con la identificación de colores, teniendo problemas en el día a día, por ejemplo, al seleccionar la combinación de colores de la ropa y ver detalles en las presentaciones de diapositivas, con los códigos de color, algunas imágenes gráficas y con la tinción de cortes histológicos. De hecho, la industria del transporte impone restricciones a la contratación de individuos con ceguera para el color en determinados puestos de trabajo.
El estudio del grupo de K. Mancuso requirió el transcurso de varios años e intentos fracasados. En última instancia, sin embargo, los investigadores lograron obtener el tipo silvestre humano del gen L-opsina para una fracción (15 a 36%) de fotorreceptores de conos a través de la inyección subretiniana de un virus recombinante, la replicación defectiva del virus adeno-asociado (AAV) (figura 1). Antes de la inyección, los colores azul-verde y rojo-violeta, eran invisibles para los monos, según lo determinado por un equipo basado en la prueba de visión del color. Cinco meses después de la inyección, los monos tenían visión tricromática, la cual se mantuvo durante más de 2 años. Los resultados de las pruebas de comportamiento se correlacionaron con las pruebas fisiológicas (llevadas a cabo 10 meses después de la inyección) en uno de los monos sometido a ambas pruebas. El informe no explica por qué se tardó 5 meses en observar este efecto, ya que podría haber sido un resultado del aprendizaje, debido a que la expresión del transgen mediado por AAV se suele detectar en cuestión de semanas después de la inyección.
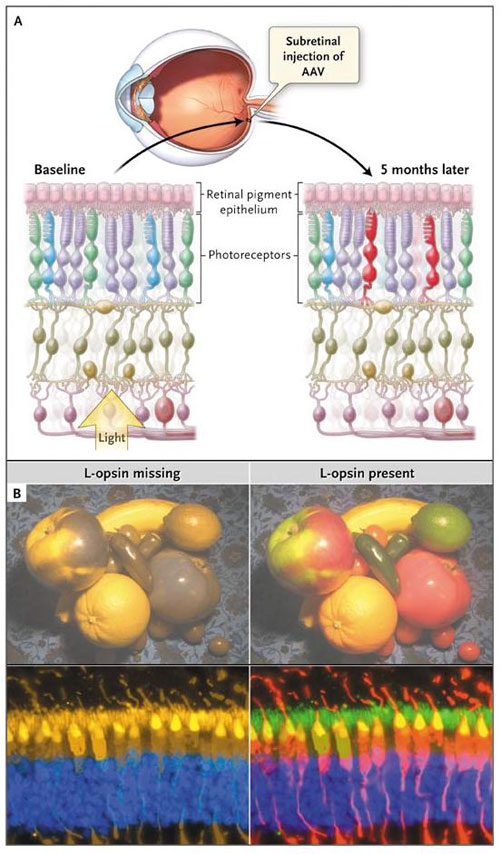
K. Mancuso y colaboradores acaban de publicar la inducción de la visión tricromática después de la introducción de pigmentos visuales faltantes (tres) en fotorreceptores de conos en monos dicromáticos. El panel A muestra el método utilizado, en el que se liberó el gen humano L-opsina tipo salvaje hacia los fotorreceptores cono a través de la inyección subretiniana de un recombinante, replicación defectiva del virus adeno-asociado (AAV). El panel B muestra cómo los animales dicromáticos carentes de pigmentos de longitud de onda larga en fotorreceptores cono pueden ver una colección de frutas y verduras, antes y después de la terapia génica (fila superior), según las secciones marcadas por inmunofluorescencia de retina (fila inferior) (Still Life cortesía de Elise Maguire; micrografía cortesía de Waixing Tang, Escuela de Medicina de la Universidad de Pennsylvania).
¿Cuáles son las implicaciones de estos resultados? ¿Este enfoque podría ser utilizado para tratar la ceguera de color en seres humanos? Dado el hecho que las personas dicromáticas pueden llevar a cabo la mayor parte de las mismas actividades que las tricromáticas y que otros aspectos de su visión son excelentes, la relación riesgo-beneficio de la terapia génica mediante inyección subretiniana para el dicromatismo no parece favorable. El hecho que la ceguera del color sea tan frecuente plantea la pregunta de si la condición debe ser considerada como una variante fenotípica en lugar de una enfermedad. El enfoque tendría que demostrar un considerable perfil de seguridad antes de la aplicación humana, especialmente porque los dos monos estudiados recibieron posterior terapia con corticosteroides, lo que sugiere que podría haber sido la inflamación. Sin embargo, es tentador considerar la posibilidad de "convertir" el dicromatismo en tricromatismo. Por extensión, la capacidad neurosensorial podría teóricamente ampliarse aún más, por ejemplo, mediante la creación de tetracromacía (encontrada en el estornino pinto), con capacidad para ver las flores tal como las ven las abejas.
Sin embargo, lo más importe de este estudio son las implicaciones respecto al tratamiento de otras enfermedades de los conos. Los resultados de la investigación sugieren que las señales que se inician a través de los conos son transmitidas a la corteza visual por el sistema nervioso central y que las conexiones neuronales presentes desde el nacimiento son capaces de procesar señales de entrada en un animal adulto.
Los investigadores describen sus resultados en forma contraria a las predicciones de Hubel y Wiesel, respecto a la privación visual. Ellos descubrieron que la prevención de la entrada visual en gatos durante un período crítico en el desarrollo alteraba la dominancia ocular en el sistema visual y que la plasticidad disminuía después de este tiempo crítico, después de lo cual no era posible revertir los dominios, aunque la entrada visual se restaure. Sin embargo, el dicromatismo tratado por Mancuso y colegas no es análogo a la ambliopía (la correlación clínica de los estudios de Hubel y Wiesel). La naturaleza de la privación sensorial en el estudio de Hubel y Wiesel fue fundamentalmente diferente, ya que afectaba a todos los aspectos de la estimulación de los fotorreceptores y daba lugar a profundos cambios orgánicos que no se describen en la deficiencia del color. Sin embargo, el grupo de K. Mancuso encontró que es posible reprogramar el antiguo cableado neuronal para transportar señales nuevamente. Suponiendo que la ambliopía no se convierta en un problema en los seres humanos, este análisis es un buen augurio para aliviar otras enfermedades de los conos, como la acromatopsia completa, distrofia de conos y bastones, y algunas maculopatías. Debería ser posible no sólo restaurar la función y obtener la visión de los conos enfermos en los ojos adultos, sino también salvar a estas células de la muerte.
Fuente bibliográfica
Gene Therapy for Color Blindness
Jean Bennett, M.D., Ph.D.
F.M. Kirby Center for Molecular Ophthalmology, Scheie Eye Institute, University of Pennsylvania School of Medicine, Philadelphia.
N Engl J Med. 2009 Dec 17; 361(25):2483-4