Cáncer de páncreas y su mala fama
El adenocarcinoma pancreático ductal (PDA) es uno de los tumores malignos humanos más difícil de tratar. Décadas de esfuerzo han sido testigos del fracaso de muchos regímenes de quimioterapia, y el estándar actual de la terapia, la gemcitabina, prolonga la supervivencia del paciente en sólo unas pocas semanas. El desarrollo de fármacos oncológicos depende en gran medida de la utilización de modelos de ratón con tumores trasplantados en donde se pueda evaluar la eficacia de los agentes. Sin embargo, estos modelos también responden a la quimioterapia con numerosos agentes, incluyendo la misma gemcitabina, lo que sugiere que su utilidad predictiva puede ser limitada. En cambio, los modelos animales genéticamente modificados ofrecen una alternativa a los modelos de trasplante para una mejor evaluación terapéutica preclínica.
La vía Hedgehog y el cáncer del páncreas
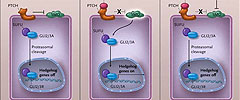
Se ha observado en varios cánceres humanos la activación anormal de la vía de hedgehog, como por ejemplo, en el cáncer pancreático. Por esta razón, los ensayos clínicos han utilizado inhibidores de la vía para evaluar su eficacia en el tratamiento de cánceres sólidos, como recientemente han descrito Daniel D. Von Hoff y colaboradores (N Engl J Med 2009; 361:1164-1172). Otro estudio, realizado por Kenneth P. Olive y colegas (Science 2009; 324:1457-1461), también sugiere que el cáncer de páncreas es un candidato particularmente idóneo para el tratamiento experimental mediante inhibidores de la vía de Hedgehog. En ausencia de ligandos, como "sonic hedgehog" (SHH), el receptor de membrana parche (PTCH) bloquea el receptor smoothened (SMO), reprimiendo su actividad. La unión del ligando SHH al receptor PTCH disminuye los efectos inhibitorios sobre SMO, permitiendo la transducción de señales a través de la vía que culmina en la activación y translocación nuclear de factores de transcripción de los dedos de zinc de la familia GLI (figura 1). Estos factores de transcripción alteran a su vez los genes en el núcleo promoviendo la proliferación celular.
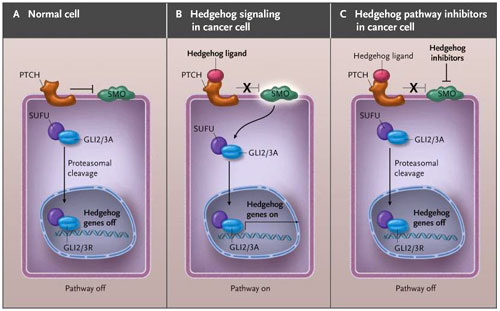
En la célula normal (panel A), el receptor de membrana parche (PTCH) se une y reprime al receptor smoothened (SMO), bloqueando el sistema de señalización de hedgehog. El factor de transcripción de los dedos de zinc de la familia GLI, GLI2 y GLI3, existe tanto a la forma de activador (A) como de represor (R), la última incapaz de inducir la transcripción de los genes hedgehog. En ausencia de ligando, GLI2A y GLI3A son unidos por el supresor del inhibidor hedgehog de fundido (SUFU) y son sometidos a escisión proteasomal por las formas represoras GLI2R y GLI3R. En las células cancerosas (panel B), la unión de los ligandos hedgehog facilita la transducción de señales. La activación de la vía hedgehog dependiente de ligando puede producirse de forma autocrina o paracrina. El tratamiento con inhibidores de la vía (panel C) restaura la represión de SMO y controla la vía Hedgehog aberrantemente activada.
Varias líneas de evidencia apoyan la idea que la señalización de hedgehog participa en el mantenimiento y progresión del cáncer de páncreas (figura 2). En primer lugar, un estudio que incluyó análisis de secuenciación señaló a la vía Hedgehog como un mecanismo de señalización "básico" que genera alteraciones somáticas en casi todos los cánceres pancreáticos. En segundo lugar, la inhibición de la señalización con ciclopamina mejora la supervivencia en ratones genéticamente modificados para el cáncer de páncreas y deroga las metástasis sistémicas derivadas de xenoinjertos ortotópicos. Además, la mantención de la señalización de hedgehog es un requisito previo para la viabilidad de las células madre del cáncer de páncreas. El bloqueo terapéutico de la vía elimina las células madre del cáncer, mejora los resultados y puede producir cura de la enfermedad en combinación con gemcitabina en modelos de xenotrasplante directo.
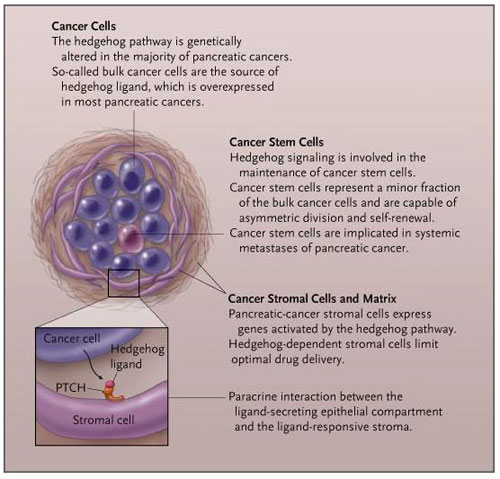
La vía de hedgehog se encuentra alterada en los tres compartimentos del cáncer de páncreas: las células diferenciadas cancerígenas (llamadas células de cáncer a granel), las células madre del cáncer y el estroma. La secreción de ligandos hedgehog por células cancerígenas pancreáticas activa la vía en los últimos dos compartimentos, potenciando el mantenimiento de las células madre del cáncer y la formación de estroma fibrótico. El recuadro muestra la señalización de hedgehog entre el epitelio y estroma neoplásico.
K. Olive y colegas, utilizaron un modelo muy penetrante y letal de ingeniería genética para el cáncer de páncreas, que permitió demostrar que IPI-926, un inhibidor de SMO, aumenta la supervivencia cuando se utiliza en combinación con gemcitabina en modelos resistentes al medicamento. Mecánicamente, se da lugar a una notable reducción en la reacción fibrosa que acompaña a estos tumores. IPI-926 también aumenta la neovascularización del tumor, lo que facilita la distribución de la gemcitabina en las células malignas. El estudio de Olive y colaboradores destaca por el uso de este modelo de ingeniería genética para el cáncer de páncreas que recapitula fielmente la enfermedad humana. También sobresale por la idea que la eliminación del estroma mejora la entrega de la droga y los efectos terapéuticos.
Es evidente la justificación de ensayos clínicos en los que se utilicen inhibidores para tratar a personas con cáncer de páncreas. ¿Cuál sería el mejor diseño? El campo de la investigación clínica en el cáncer de páncreas está lleno de investigaciones con resultados negativos. A pesar de este pobre historial, que refleja el carácter agresivo de la enfermedad, o la falta de eficacia de los agentes probados, también parece probable que las estrategias óptimas de desarrollo de fármacos y diseño de ensayos clínicos se han traducido en el fracaso de fármacos potencialmente eficaces o en un despilfarro de recursos (por ejemplo, la realización de grandes ensayos clínicos con pacientes, cuando cientos de ensayos más pequeños podrían haber bastado para justificar el abandono de los agentes ineficaces). Los conocimientos preclínicos acumulados generados de experimentos bien diseñados en modelos de ratón biológicamente relevantes presionan a hacerlo bien.
El primer paso debe ser el diseño de estudios para determinar si alguna nueva generación de inhibidores puede lograr algunos de los efectos mecánicos demostrados en tales modelos, tales como la represión génica de hedgehog, la eliminación de las células madre del cáncer, reducción en el estroma y un aumento en la densidad vascular. Esto podría lograrse mediante la administración de medicamentos antes de la resección quirúrgica en pacientes con enfermedad operable, con análisis biológicos posteriores de la pieza resecada, y tales estudios podrían optimizarse mediante la incorporación de técnicas de imagen en tiempo real.
Con respecto al efecto terapéutico, se desprende de los estudios preclínicos que los inhibidores hedgehog deben ser examinados en combinación con gemcitabina, el actual tratamiento estándar. Hay tres posibilidades. Una de ellas sería un ensayo en pacientes con cáncer de páncreas metastásico. Este diseño, sin embargo, es probablemente el menos óptimo, ya que las células madre del cáncer, que están implicadas en la metástasis sistémica y son uno de los objetivos clave para los antagonistas hedgehog, pueden ser de menor importancia, cuando la neoplasia ya ha producido metástasis. Además, aunque el cáncer pancreático primario es rico en estroma es menos probable la metástasis cancerígena. Tampoco son tan hipovasculares como los cánceres primarios.
Alternativamente, los inhibidores hedgehog pueden ser evaluados en pacientes con tumores resecables después de la cirugía. Aquí, el objetivo clínico más importante es la eliminación de la enfermedad micrometastásica, donde las células madre del cáncer tienen probablemente un papel fundamental.
El estudio del grupo de K. Olive sugiere que una tercera clase de pacientes, aquellos con enfermedad localmente avanzada, son los más susceptibles de beneficiarse de un enfoque terapéutico con la inhibición de la vía de hedgehog. Este subgrupo representa hasta un 30% de los individuos en el momento del diagnóstico, con un tipo de cáncer caracterizado por un estroma rico en tumores hipovasculares que no puede ser resecado debido a la existencia de grandes vasos. En la actualidad, el cuidado se gestiona con gemcitabina seguida de quimiorradioterapia, por lo general con resultados muy pobres.
Fuente bibliográfica
The Hedgehog Pathway and Pancreatic Cancer
Manuel Hidalgo, M.D., and Anirban Maitra, M.D.
From the Clinical Research Program, Centro Nacional de Investigaciones Oncológicas, Madrid (M.H.); and the Sol Goldman Pancreatic Cancer Research Center, Johns Hopkins University School of Medicine, Baltimore (A.M.).
N Engl J Med. 2009 Nov 19; 361(21):2094-2096