Para tratar la leucemia, el interferón alfa
Los interferones tienen un papel clave en la mediación de las respuestas antivirales y anticrecimiento, y en la modulación de la respuesta inmune. Sus principales vías de señalización son rápidas y directas. Implican la fosforilación de la tirosina y activación de transductores de señales y de factores de transcripción denominados tirosina quinasas de Janus (JAKs) en la membrana celular, seguido por la liberación de los transductores de señales y activadores de la transcripción y su migración al núcleo, donde inducen la expresión de muchos productos génicos que determinan las respuestas. Algunas vías auxiliares también son activadas por el interferón, pero sus efectos sobre la fisiología celular son menos claros. Las quinasas Janus, los transductores de señal y activadores de la transcripción, y muchas de las proteínas inducidas por el interferón, desempeñan importantes funciones alternativas en las células, planteando cuestiones interesantes sobre la manera de cómo las respuestas a los interferones se entrecruzan con aspectos más generales de la fisiología celular y cómo se mantiene la especificidad de las respuestas de las citoquinas.
Diversos estudios clínicos han señalado que el uso del interferón alfa, en comparación con agentes quimioterapéuticos, es capaz de inducir la supresión de la neoplasia, erradicar el clon cromosoma Ph positivo y permitir la restauración de la hematopoyesis en una minoría de pacientes con leucemia mieloide crónica (LMC). Este logro ha demostrado tener un beneficio significativo de supervivencia.
Células leucémicas susceptibles al ataque
Se cree que el interferón alfa, una citoquina producida de forma natural, ejerce su efecto antitumoral a través de mecanismos pleiotrópicos que incluyen la modulación de la respuesta inmune y la inhibición de la angiogénesis. Además, controla el crecimiento y promueve la apoptosis de muchos tipos celulares. Un reciente estudio de Marieke Essers y colegas [Nature. 2009 Apr 16; 458(7240):904-8] proporciona una nueva comprensión de los efectos del interferón alfa sobre las células madre hematopoyéticas, revelando efectos proliferativos en esta población de células en reposo. Los resultados también sugieren una potencial aplicación terapéutica de los interferones para aumentar la sensibilidad de las células a la quimioterapia citotóxica.
La cualidad esencial de una célula madre benigna es su capacidad no sólo para regenerarse (auto-renovación), sino también para dar lugar a células progenitoras hijas capaces de diferenciarse en una multitud de tipos de células maduras. Este acto de división y regeneración ocurre con poca frecuencia, en donde la proliferación celular se da principalmente a nivel de células progenitoras. Por lo tanto, las verdaderas células madre están generalmente inactivas, pero pueden ser inducidas a proliferar en tiempos de estrés, como cuando se daña el tejido.
La hipótesis de las células madre del cáncer se basa en la biología de las poblaciones benignas como un modelo para explicar las dos observaciones más importantes en la biología del cáncer: en primer lugar, un solo tumor puede incluir tipos de células heterogéneas, y en segundo lugar, para muchos tipos de cáncer sólo un subgrupo de células tumorales son capaces de recapitular la enfermedad cuando se trasplantan en modelos animales. De hecho, algunos tipos de cáncer parecen derivarse de células madre mutantes, de células progenitoras, o de ambas. A la inversa, ciertos acontecimientos pueden dotar a los tumores con características de células madre o de capacidad de respuesta a los mecanismos reguladores de las células madre que se auto-renuevan
Aunque hay pruebas de que los altos niveles de interferón gamma en la médula ósea de las personas con anemia aplásica acaban con la proliferación de células progenitoras hematopoyéticas, el grupo de M. Essers encontró que el interferón alfa directamente puede inducir la proliferación en ratones. Cuando éstos se tratan con interferón alfa o una doble cadena de ARN mimética de ácido poliniosínico-policitidílico (poli [I:C]), que simula una infección viral y provoca la secreción endógena de interferones, se halló que una significativa proporción de células madre hematopoyéticas se encontraban en ciclo celular (es decir, proliferando). Para demostrar el efecto directo del interferón alfa sobre las células madre hematopoyéticas, los investigadores concluyeron que los genes diana del interferón eran inducidos en las células madre hematopoyéticas de ratones tratados con interferón alfa.
Los autores pasaron a demostrar, como una prueba de principio, que el interferón alfa inducido altera las células madre hematopoyéticas en el ciclo celular antes de la quimioterapia generando ratones con más probabilidades de morir de anemia aguda, mientras que las muertes no fueron observadas en los tratados de la misma manera, pero que eran deficientes para el receptor del interferón alfa. En ausencia de estrés citotóxico de la quimioterapia, la terapia a largo plazo de ratones con interferón alfa no dio lugar a la pérdida o agotamiento de las células madre hematopoyéticas. Sin embargo, un defecto funcional (con respecto a la acción del interferón alfa en estas células) fue observado en receptor del interferón alfa de ratones híbridos. En los animales en los que la mitad de las células madre hematopoyéticas carecía del receptor, el tratamiento a largo plazo con interferón alfa llevó a un agotamiento de las células madre hematopoyéticas positivas para el receptor. En otras palabras, la administración a largo plazo de interferón alfa concedió ventaja competitiva para la supervivencia de las células madre hematopoyéticas en la médula ósea que tenían deficiencia de este tipo de receptores. Los autores infirieron que la exposición a corto plazo de las células madre hematopoyéticas latentes con interferón alfa transformó la latencia a un estado activo de proliferación, mientras que la exposición a largo plazo afectó su función, pero no eliminó las células madre hematopoyéticas.
El interferón alfa se utiliza actualmente en el tratamiento del carcinoma de células renales y en el melanoma, dos tumores relativamente inmunogénicos. Antes de la introducción de imatinib, el interferón alfa era un tratamiento de primera línea para la leucemia mieloide crónica (LMC). Su eficacia implicaba un aumento de la inmunidad tumoral mediada por células T, aunque su mecanismo de acción no ha sido completamente aclarado y probablemente sea multifactorial. Sobre este punto, M. Essers y colegas realizaron una observación interesante. Señalan que un subgrupo de pacientes tratados previamente con interferón alfa antes de recibir imatinib tenía una elevada tasa de remisión que se mantenía después de la interrupción del medicamento. Sobre la base de esta conclusión, plantearon la hipótesis que el reclutamiento de células madre LMC latentes en el ciclo celular puede hacer más susceptible la erradicación mediante el posterior tratamiento con el inhibidor de la tirosina quinasa (figura 1). Este enfoque podría aumentar la probabilidad de una cura efectiva para la LMC sin necesidad de trasplante, disminuyendo así la exigencia de un manejo a largo plazo para suprimir la enfermedad.
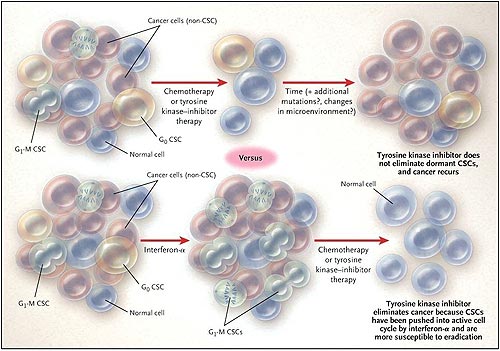
El interferón alfa induce a las células madre hematopoyéticas para salir del estado latente y entrar en la fase proliferativa del ciclo celular. Los autores de este estudio proponen que "preparar" a los pacientes con leucemia mieloide crónica con interferón alfa antes de recibir el inhibidor de la tirosina quinasa (TKI) podría inducir a las células madre del cáncer (CSCs) para entrar en el ciclo celular, haciéndolas más susceptibles a la eliminación. G1-M denota la fase activa del ciclo celular (interfase y mitosis) y G0 la fase de latencia (reposo).
Aunque queda por ver si estas observaciones son confirmadas en grandes cohortes de pacientes, la aplicación de las lecciones aprendidas a partir del estudio de células madre benignas para el tratamiento del cáncer puede ser muy productiva. Los paralelismos que surgen entre el comportamiento normal de las células madre y la biología del cáncer probablemente conducirán a mejoras terapéuticas, tales como el diseño de dianas moleculares que "golpeen" directamente las células madre del cáncer en vez de las normales, así como nuevas formas de unidades latentes y células quimiorresistentes "salidas de su escondite", pudiendo ser más susceptibles a la erradicación.
Fuente bibliográfica
Rendering the Leukemia Cell Susceptible to Attack
Dorothy A. Sipkins, M.D., Ph.D.
Section of Hematology/Oncology, Department of Medicine, University of Chicago, Chicago, USA.
N Engl J Med. 2009 Sep 24; 361(13):1307-9


