Interacción plaquetas-eritrocitos, clínicamente beneficiosa
La inmunidad adaptativa a la infección por malaria se va acumulando lentamente a lo largo de la vida de una persona que vive en una región endémica. La inmunidad cruzada entre cepas es baja, y cada nueva infección requiere el desarrollo de una nueva respuesta inmune. Por lo tanto, los mecanismos innatos que limitan el crecimiento del parásito en los glóbulos rojos son extremadamente importantes en la determinación de la supervivencia, sobre todo durante los primeros años de vida, debido a que la gravedad clínica se correlaciona estrechamente con la cantidad de parásitos.
Se conocen varias mutaciones que afectan a los glóbulos rojos y reducen la gravedad de la infección, ya sea a través de impedir la entrada o el desarrollo del parásito dentro de la célula. Sin embargo, sabemos muy poco acerca de los otros mecanismos que no están asociados a los glóbulos rojos que pueden influir en el curso de la infección antes de la aparición de una respuesta inmune adaptativa.
Plaquetas, fiebre y plasmodios
Desde hace mucho tiempo se sabe que las plaquetas interactúan con los eritrocitos en forma cooperativa en la trombogénesis, tanto en general como en pacientes con enfermedad de células falciformes. Recientemente, han comenzado a ser dilucidados los mecanismos moleculares por los que los neutrófilos pueden mantener sus interacciones con las células endoteliales. Un reciente estudio realizado por Brendan J. McMorran y colaboradores (Science 2009; 323:797-800) plantea la posibilidad de que la interacción plaquetas-eritrocitos puede ser clínicamente beneficiosa en pacientes con paludismo. Esta condición es causada, en los seres humanos, por cuatro parásitos del género Plasmodium: Plasmodium falciparum, P. vivax, P. ovale y P. malariae . La malaria por P. falciparum se asocia con la mayoría de las muertes, en donde los niños se llevan un gran porcentaje. Los síntomas asociados a la malaria grave por P. falciparum generalmente incluyen fiebre elevada y acidosis metabólica, así como distrés respiratorio, anemia, hipoglucemia, convulsiones, y, en la infancia, edema cerebral y coma.
Algunos estudios han sugerido que la trombocitopenia es un marcador de mal pronóstico en la malaria, y el grupo de B. J. McMorran demostró muy bien que la infección de los eritrocitos con P. falciparum aumenta la interacción con las plaquetas que son mortales para el parásito - sugiriendo un papel de las plaquetas como efectores inmunes innatos (figura 1). No se trata de una nueva observación, y los resultados pueden ser considerables, con un máximo de tasa de letalidad parasitaria del 65%. Ahora, sin embargo, esta letalidad ha sido replicada en ratones con trombocitopenia. Estos tienen una décima parte del número de plaquetas en comparación a los de tipo salvaje, debido a la supresión homocigótica del gen que codifica el receptor trombopoyético c-MPL, y tienen mayor mortalidad después de exponerlos a P. chabaudi (una especie plasmodio que, a diferencia de P . falciparum, infecta a roedores). Los autores descartaron posibles factores de confusión como causa de muerte - entre ellos un aumento de la hemorragia o hemólisis y la disminución de la eritropoyesis o la producción de citoquinas o linfocitos - aunque otros efectos desconocidos asociados con la supresión del gen c-MPL no deberían ser excluidos.
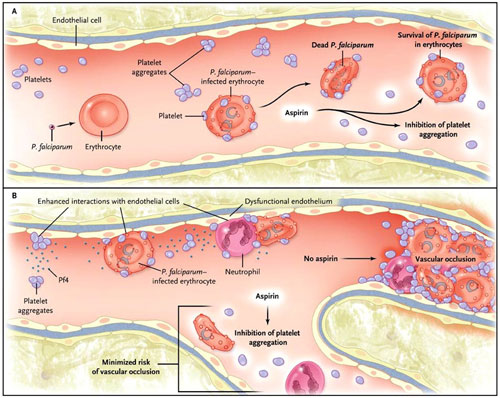
B. J. McMorran y colaboradores concluyeron recientemente que los eritrocitos infectados con Plasmodium falciparum activan las plaquetas e inducen la formación de complejos plaquetas-eritrocitos que provocan la muerte de los parásitos (panel A). La inhibición de la activación plaquetaria a través del uso de aspirina (inhibición por medio de manipulación genética) controla, pero no suprime, en eritrocitos con infestación similar, al parásito P. chabaudi en ratones. Por lo tanto, si se extrapolan estas observaciones a la infección por P. falciparum en seres humanos, podrían ser indeseables los efectos de la aspirina en el manejo febril de la enfermedad en las primeras etapas. En cambio, Kalyan Srivastava y colegas describieron un escenario en el que la inhibición plaquetaria con aspirina podría ser conveniente (grupo B). Ello demostraron - con ratones infectados por P. berghei - que el factor plaquetario 4 (PF4) facilita la interacción entre las células endoteliales y los eritrocitos, exacerbando la malaria cerebral, y, potencialmente, la oclusión vascular.
En el estudio del grupo de McMorran la parasitemia fue controlada y sólo resurgió después de 11 días de infección, con una trombocitopenia persistente a lo largo de este período. Además, como la aspirina inhibe la función plaquetaria, aumentó la parasitemia con P. chabaudi en ratones, y las plaquetas recolectadas de voluntarios que tomaron aspirina (aproximadamente 300 mg por día) durante una semana no eliminaron a los eritrocitos infectados con P. falciparum en vivo.
Por lo tanto, ¿deberían las personas con malaria evitar tomar aspirina y aquellas con trombocitopenia y malaria recibir infusiones de plaquetas? La aspirina se usa comúnmente en el tratamiento de la fiebre en niños que viven en zonas de paludismo endémico. Esta práctica continúa, a pesar del abandono de la aspirina para el tratamiento de los síndromes pediátricos febriles en los países desarrollados debido a su asociación con el síndrome de Reye, una enfermedad que imita los síntomas cerebrales de la malaria. De hecho, el supuesto transcurso benigno de la malaria severa en el Pacífico Sur en comparación a los países africanos está vinculado a la reducción del uso del medicamento. Las dosis pediátricas (75 a 100 mg por día) se utilizan principalmente para la cardioprotección de los adultos en los países desarrollados. El paracetamol, que también es un inhibidor de la ciclooxigenasa, se usa en algunas comunidades como alternativa antipirética y probablemente logra su efecto a través del mismo mecanismo molecular de la aspirina. No obstante, es más caro y lleva un riesgo potencial de hepatotoxicidad. Un problema mayor es que no existen pruebas que el tratamiento farmacológico de la fiebre afecte los resultados en pacientes con malaria, y no existe evaluación comparativa de los riesgos y beneficios de la aspirina y el paracetamol en poblaciones con desnutrición. Dada la moda de iniciar rápidamente el manejo antipalúdico en el hogar, parece prudente evitar la aspirina o el paracetamol, independientemente de los resultados de McMorran y colegas.
Otra razón para ser conservadores a la hora aumentar el recuento de plaquetas en pacientes con malaria es que la interacción de las plaquetas con los eritrocitos infectados puede agravar el paludismo cerebral. Un estudio animal de infección realizado por K. Srivastava y colegas indica que los eritrocitos infectados con P. berghei interactúan con las plaquetas activadas y, por consiguiente, secretan el factor plaquetario 4 (PF4 o Cxcl4); que a su vez, exacerba la malaria cerebral. Además, las interacciones plaquetas-eritrocitos pueden facilitar la trombogénesis, especialmente en personas con disfunción endotelial. Altos niveles de micropartículas plaquetarias han sido asociados con el coma en este tipo de pacientes. Así pues, aunque se podría discutir si las observaciones sobre P. berghei o P. chabaudi en ratones podrían predecir las consecuencias de la infección por P. falciparum, la inhibición plaquetaria en estos individuos podría ser conveniente. En este sentido, hay pruebas que ciertas dosis de aspirina pueden alterar la inducción de un fenotipo protrombótico por las plaquetas en los eritrocitos.
Los artículos de B. J. McMorran y K. Srivastava realzan las complejidades y los contrastantes de la función plaquetaria durante la evolución de la respuesta del hospedador a la invasión de los parásitos del paludismo. Un efecto indirecto de este trabajo es poner de relieve la escasa base de pruebas respecto al uso de la aspirina y del paracetamol como antipiréticos en pacientes que supuestamente padecen malaria.
Fuente bibliográfica
Platelets, Pyrexia, and Plasmodia
Doron C. Greenbaum, Ph.D., and Garret A. FitzGerald, M.D.
Department of Pharmacology and the Institute for Translational Medicine and Therapeutics, University of Pennsylvania, Philadelphia, USA.
Engl J Med. 2009 Jul 30; 361(5):526-8


