Evitar la hipoxia tumoral, fundamental
Existe una paradoja en la biología tumoral que sólo se hizo evidente con los fármacos antiangiogénicos en modelos animales y ensayos clínicos. La mayoría de los tumores requieren su propio suministro de sangre para crecer, y una vez que activan el "interruptor angiogénico", son capaces de inducir la formación de vasos sanguíneos para satisfacer sus necesidades metabólicas. Se pensaba que los compuestos que bloquean la angiogénesis tumoral serían eficaces contra el cáncer, para hasta la fecha los fármacos disponibles sólo bloquean transitoriamente el crecimiento neoplásico. Probablemente existen muchas razones para este resultado, pero una posibilidad interesante se centra en las características de los vasos sanguíneos inducidos por el tumor. Éstos son ineficientes en el suministro de oxígeno. Como resultado de ello, el tumor se ve privado de oxígeno, o hipoxia. Este estado de deficiencia estimula las células tumorales para continuar la producción de citoquinas y los factores de crecimiento, incluyendo los proangiogénicos que a su vez estimulan los vasos sanguíneos del tumor manteniéndolos disfuncionales.
Se ha propuesto que "normalizar" los vasos sanguíneos mejora el tejido tumoral al desregular las vías de señalización que contribuyen al crecimiento del cáncer.
Nuevo objetivo para la terapia tumoral
La normalización vascular, o el restablecimiento de la estructura y función en los vasos sanguíneos, surge como estrategia para tratar el cáncer y otros trastornos vasculares. Massimiliano Mazzone y colaboradores (Cell 2009; 136(5):839-851) han propuesto recientemente un nuevo enfoque para la normalización vascular: centrarse en la proteína de dominio prolil hidroxilasa 2 (PHD2), un sensor del balance de los niveles de oxígeno. Estos autores encontraron que la haplodeficiencia (es decir, la mitad de la dosis "normal") de PHD2 "normaliza" las células endoteliales en los tumores, resultando un aumento de oxigenación y disminución de la metástasis.
En tejidos normales, el equilibrio entre las señales proangiogénicas y antiangiogénicas mantiene la estructura normal del revestimiento de las células endoteliales, pericitos circundantes, y la membrana basal vascular, a fin de garantizar una óptima función. En los tumores, a causa de mecanismos genéticos y epigenéticos (por ejemplo, mecanismos genéticos iniciados por oncogenes y mecanismos epigenéticos iniciados por la hipoxia), este equilibrio se inclina hacia el lado proangiogénico y, por ende, la estructura de la pared del vaso se convierte en anormal. Los pericitos se separan de las células endoteliales, la membrana basal se vuelve demasiado delgada o gruesa, y el revestimiento endotelial se convierte en irregular y discontinuo. El resultado neto es una disfunción vascular que alimenta la progresión tumoral y la resistencia al tratamiento (figura 1).
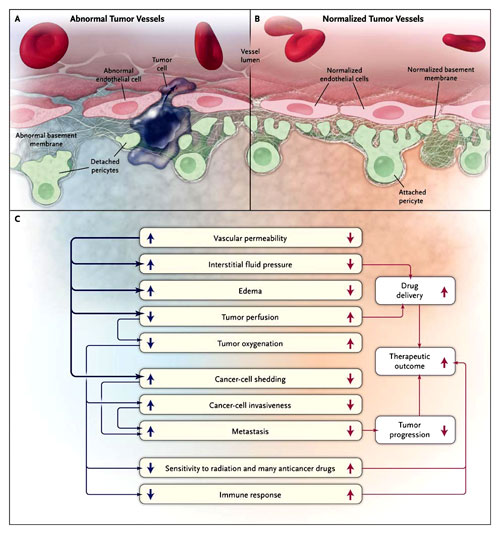
Como se indica en el panel A, los vasos del tumor tienen un revestimiento de células endoteliales deficiente, pericitos separados y una membrana basal que es anormalmente espesa o delgada. Estas alteraciones estructurales - resultado de la excesiva producción de moléculas proangiogénicas como el factor de crecimiento endotelial vascular (VEGF) y la desregulación de moléculas antiangiogénicas como la trombospondina - pueden hacer hiperpermeable los vasos del tumor. Como se indica en el panel B, al restablecer el equilibrio entre las señalizaciones proangiogánicas y antiangiogénicas en las células endoteliales, los vasos tumorales empiezan a normalizarse estructural y funcionalmente. Esto reduce la invasión de células cancerígenas en la sangre y en el sistema linfático, disminuyendo el número de unidades en circulación y, en última instancia, evita la metástasis. Como se indica el panel C, la menor infiltración tumoral reduce la perfusión y oxigenación. La reducción de los niveles de oxígeno puede afectar la respuesta inmune, disminuir la eficacia de muchas terapias contra el cáncer y estimular las células cancerosas más invasoras. Las flechas azules indican las variables asociadas con vasos anormales, y las flechas rojas indican las variables relacionadas con vasos normalizados. Un estudio reciente realizado por M. Mazzone y colegas demuestra que células endoteliales con niveles reducidos de PHD2 pueden estabilizar los vasos tumorales mediante la sobreregulación de la producción de los receptores de VEGF soluble 1 (VEGFR-1) y VE-cadherina (una molécula de adhesión). Estas observaciones sugieren que los agentes anti-PHD2, una vez desarrollados, podrían utilizarse para reducir el edema y sensibilizar las células tumorales a la terapia de radiación y medicamentos quimioterapéuticos.
La correcta aplicación de agentes antiangiogénicos puede restablecer el equilibrio entre las señalización proangiogénica y antiangiogénica y, por tanto, "normalizar" la vasculatura tumoral (figura 1). Además de ser más eficiente para el suministro de oxígeno y medicamentos, la normalización de los vasos previene la metástasis al obstaculizar las células cancerosas. La normalización vascular también reduce la hipoxia tisular y la presión del líquido intersticial. El aumento de los niveles de oxígeno sensibiliza las células cancerosas a la radioterapia y la quimioterapia, y aumenta la respuesta inmune al tumor. La reducción de la presión intersticial reduce el tumor asociado a la hinchazón (edema) y disminuye la probabilidad de metástasis linfáticas. Independiente de estos efectos, el alivio de la hipoxia baja la presión selectiva sobre las células cancerosas y evita así la evolución de un fenotipo más maligno. Estas consecuencias de la normalización han sido validadas en trabajos de investigación y en el ámbito clínico.
El estudio del grupo de M. Mazzone demuestra que, en ratones, las células endoteliales de tumor haplodeficientes en PHD2 mantienen las normales características morfológicas tipo "adoquines". Este revestimiento normalizado ofrece resistencia a las células cancerígenas, disminuyendo el desprendimiento de células malignas hacia la circulación y, en última instancia, reduce la metástasis. También mejora la perfusión de los vasos y reduce la hipoxia en los tumores (figura 1). Se sabe que la hipoxia permite la selección de células cancerosas que son invasoras y móviles. Así, la normalización también reduce la invasión de unidades cancerosas a la sangre y vasos linfáticos.
La publicación de M. Mazzone también ofrece un mecanismo molecular de normalización de células endoteliales mediante la reducción en la actividad PHD2. Al estabilizar la hipoxia inducida por factores de transcripción, la haplodeficiencia de PHD2 aumenta el factor de crecimiento endotelial vascular (VEGF) del receptor 1 (VEGFR-1) y la VE-cadherina (una molécula de adhesión) en las células endoteliales. El VEGFR-1 soluble bloquea la unión del VEGF en exceso - producido por el cáncer y otras células del estroma en el microambiente tumoral - a los receptores de VEGF en las células endoteliales. Este bloqueo, a su vez, asegura que las células endoteliales sean quiescentes. Paralelamente, la VE-cadherina estrecha el revestimiento de las células endoteliales.
Mazzone y colegas observaron, sin embargo, que PHD2 haplodeficiente no inhibe el crecimiento tumoral en modelos preclínicos. Se ha demostrado recientemente que incluso frente a la persistencia del tumor, la normalización vascular puede prolongar la supervivencia - en los ratones y, posiblemente, en pacientes con tumores cerebrales - por alivio del edema asociado al tumor. Así, la monoterapia anti-PHD2 puede mejorar la supervivencia en algunas enfermedades. Sin embargo, para prolongar la vida, el manejo anti-PHD2 tendría que ser combinado con agentes que destruyen las células cancerosas.
Los principios anti-VEGF normalizan transitoriamente los vasos tumorales; esta ventana dura menos de una semana en modelos preclínicos y un mes en pacientes con glioblastomas recurrentes. La terapia citotóxica durante este periodo conduce a un mejor resultado en comparación al mismo tratamiento realizado fuera de esta ventana. Por lo tanto, parece prudente medir la duración de la ventana creada por los agentes anti-PHD2. Otra lección aprendida a través del bloqueo de la vía de VEGF es la moderación, el bloqueo de demasiados vasos tumorales compromete la entrega de tratamientos citotóxicos y provoca la hipoxia. Por lo tanto, la dosis de agentes contra PHD2 debe ser valorada cuidadosamente. Por último, los tumores desarrollan resistencia a las terapias anti-VEGF a través del cambio a otras vías angiogénicas o integración de vasos sanguíneos de mayor crecimiento. En comparación con células malignas, las células endoteliales son genéticamente estables, por lo que hay menos probabilidad de que se desarrolle resistencia a los agentes anti-PHD2, aunque esta posibilidad no puede descartarse. A pesar de estas advertencias, los agentes anti-PHD2 nos ofrecen un nuevo enfoque para el tratamiento del cáncer y otras enfermedades caracterizadas por anomalías en los vasos sanguíneos.
Fuente bibliográfica
A New Target for Tumor Therapy
Rakesh K. Jain, Ph.D.
Edwin L. Steele Laboratory for Tumor Biology, Department of Radiation Oncology, Massachusetts General Hospital, and Harvard Medical School, Boston.
N Engl J Med. 2009 Jun 18; 360(25):2669-71


