Inmunidad fetal: lección de tolerancia
Hace ya cincuenta años que por primera vez algunos autores postularon el concepto que "la tolerancia inmunológica adquirida activamente" en el ratón se produce como consecuencia de la exposición fetal a los antígenos. Desde entonces, se han registrado numerosos informes que sugieren que la transferencia de antígenos externos (incluyendo proteínas, parásitos e incluso células) de la madre al feto suele ocurrir con frecuencia, pero lamentablemente, el mecanismo por el cual el sistema inmunitario del feto reconoce y responde a dichos antígenos aún no se ha dilucidado.
Las diferencias temporales en el desarrollo adaptativo del sistema inmune varían sustancialmente entre especies. Por ejemplo, los ratones recién nacidos muestran pocas señales de colonización de células T periféricas, mientras que en el feto humano, los tejidos linfoides periféricos son poblados por células T a las 10 semanas de gestación. Por lo tanto, no está claro si la inducción de tolerancia en el útero se produce por a la exposición fetal a los antígenos. De hecho, no se sabe mucho sobre las propiedades funcionales del sistema inmunitario del feto humano: algunos informes sugieren que es funcionalmente deficiente, mientras que otros indican que las respuestas inmunológicas del feto a los agentes patógenos y las vacunas están intactas.
Influencia materna sobre la inmunidad fetal
La mayoría de la gente estaría de acuerdo que las madres son personajes muy influyentes en la formación de los hijos, en todos los aspectos. Un estudio reciente realizado por el Jeff E. Mold y colegas (Science 2008; 322:1562-1565) revela una nueva faceta de la influencia materna: las células inmunitarias maternas "enseñan" al feto cómo equilibrar sus necesidades de defensa propia, por un lado, y el requerimiento de tolerancia inmunológica, por otro. El equilibrio es fundamental. Demasiada moderación de la inmunidad podría conducir a una infección letal en los recién nacidos, muy poca podría conducir a la autoinmunidad.
El estudio de Mold y colegas ofrece un raro vistazo a la evolución de la adaptación del sistema inmune humano, y sugiere que el balance cambia notablemente, en el útero, hacia la tolerancia por medio de la inducción preferencial de los linfocitos conocidos como células T reguladoras. Los investigadores compararon leucocitos de tejidos linfáticos de fetos con 20 semanas de gestación versus leucocitos de sangre de cordón umbilical, de timo de lactantes y de ganglios linfáticos y sangre periférica de adultos. No se observaron desviaciones en las células T reguladoras en el timo fetal. Al igual que en el timo de los lactantes y de los adultos, sólo un pequeño número de células CD4 T (5 a 10%) fueron reguladoras, según lo indicado por la expresión del marcador de células T reguladoras, la proteína FOXP3 (un factor de transcripción nuclear). En contraste, se observó una tendencia hacia las células T reguladoras entre un 20 y un 25% en los ganglios linfáticos del feto y bazo, en donde las células T maduras van a “encontrar” antígenos. Esta inclinación desapareció en el momento del nacimiento y no se observó en ganglios linfáticos de adultos. Los procedentes de células madre se beneficiaron de esta desviación transitoria inmune; por consiguiente, dicho hallazgo podría tener consecuencias de gran alcance para la salud humana y enfermedad.
¿De dónde viene este notable sesgo en favor de la tolerancia en la adaptación del sistema inmune del feto? En humanos, las células T plenamente competentes emergen del timo del feto y se dirigen hacia los ganglios linfáticos periféricos (figura 1). Las células T derivadas de células madre que tienen más probabilidades de ser la progenie de las pluripotentes que han cruzado la barrera placentaria logran evitar la eliminación del feto por las células asesinas naturales. Dado que una elevada proporción de células maduras en un repertorio de células T son capaces de reconocer antígenos HLA extraños, muchas células T detectarán células madre así como antígenos HLA solubles codificados por los alelos de HLA no heredados y someterlos a la activación. Las células T activadas inducen la interleuquina-2 y expresan el receptor de interleuquina-2 de alta afinidad, por lo que proliferan y se diferencian en células T efectoras. Éstas últimas fácilmente pueden acabar con las células foráneas, como ocurre habitualmente en adultos que han recibido transfusiones o transplantes.
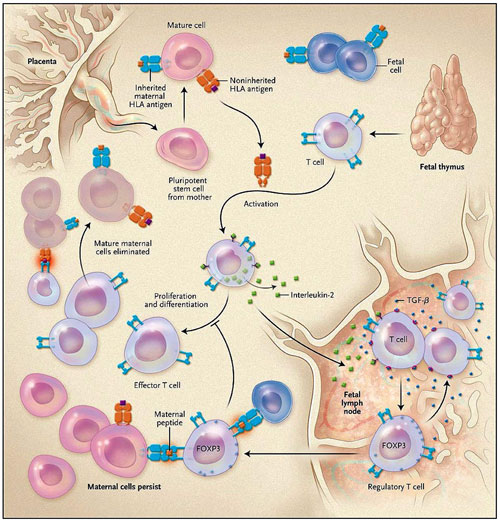
J. E. Mold y colegas han descrito un mecanismo mediante el cual se inicia la tolerancia fetal hacia los antígenos de la madre. Se detallan los antígenos HLA no heredados (naranja) y los heredados de la madre (azul). Los antígenos HLA maternos no heredados incluyen a los HLA intactos reconocidos por las células T efectoras fetales y los péptidos maternos reconocidos por FOXP3 positivos para las células T reguladoras. También se esquematizan los diferentes resultados de las células T efectoras frente a las células T reguladoras con respecto a la persistencia de las células madre maduras (microquimerismo).
Sin embargo, los autores encontraron que los ganglios linfáticos del feto no provocaron una fuerte respuesta inmune a los antígenos, sino que se comportaron más como un privilegiado lugar inmunológico, donde la regulación de la inmunidad materna permitió sobrevivir a las células T, en lugar de que la sensibilización específica de antígenos se viese favorecida. Los nodos linfáticos fetales generaron una abundancia del factor de crecimiento transformante β (TGF-β). El TGF-β, en combinación con antígenos e interleuquina-2, estimula la expresión de FOXP3 y la inducción de células T reguladoras que son específicas para antígenos maternos. Estas células supresoreas, bloquean la proliferación de células T efectoras y protegen al resto de las células madre de la destrucción. El resultado fue un microquimerismo materno (hasta el 0,8% de las células madre) en el feto, 10 veces superior a lo informado anteriormente en adultos.
Poco después de su nacimiento, los ganglios linfáticos ya no son un medio ambiente tan acogedor para las células madre. Sin embargo, Mold y colaboradores encontraron pruebas de una persistencia de células T reguladoras en algunos, pero no en todos, adultos jóvenes e hijos sanos de una determinada familia. Ciertas células T reguladoras positivas para FOXP3 inducidas en el feto pueden sobrevivir largamente en la memoria de las células T del adulto, como sugieren los autores. Alternativamente, la generación de nuevas células T reguladoras puede requerir el aporte adicional de antígenos en la lactancia, en el transcurso del microquimerismo materno, o en ambos, para mantener la tolerancia.
La expansión de las células T reguladoras antígeno-específicas, tanto ex vivo como in vivo, se está desarrollando como una estrategia clínica para promover la tolerancia y, por tanto, para reducir o eliminar por completo la carga de los fármacos inmunosupresores en personas transplantadas. Los resultados de Moldes y colegas sugieren que las células T reguladoras antígeno-específicas y el microquimerismo probablemente son complementarios. La regulación de las células T reguladoras podría combinarse con el trasplante de células a fin de maximizar la inducción y el mantenimiento de la tolerancia. Sería importante determinar con precisión qué tipo de células madre maternas genera microquimerismo y tolerancia en el feto. Actualmente, las estrategias para reducir al mínimo los efectos secundarios de los fármacos inmunosupresores en el trasplante renal (como la retirada de los corticosteroides o ciclosporina) se aplican indistintamente, con un importante riesgo de rechazo agudo o crónico del injerto. Tal vez los pacientes, en particular los relacionados con donantes vivos, podrían ser evaluados antes del trasplante para determinar los niveles de microquimerismo y de células T reguladoras.
La alta tasa de éxito clínico relacionada con el trasplante de órganos y de células madre hematopoyéticas cuando el donante o el receptor expresa antígenos no heredados de la madre podría explicarse por la influencia de las células T reguladoras, idea fuertemente apoyada por un reciente ensayo realizado en ratones. Las células T reguladoras inducidas maternalmente también pueden explicar la menor incidencia de anticuerpos potencialmente perjudiciales en pacientes que han estado expuestos a antígenos maternos no heredados a través del embarazo, transfusiones de sangre o trasplante, sin embargo, independientemente de los efectos del microquimerismo materno, las células B también podrían tener una función determinada.
Todavía queda mucho más por aprender sobre las formas tolerogénicas e inmunogénicas del microquimerismo. Por el momento, sin embargo, es maravilloso tal efecto materno y el proceso hacia la tolerancia establecido en nosotros antes de nacer.
Fuente bibliográfica
A Lesson in Tolerance — Maternal Instruction to Fetal Cells
William J. Burlingham, Ph.D.
Department of Surgery, Division of Transplantation, University of Wisconsin Medical School, Madison
N Engl J Med. 2009 Mar 26; 360(13):1355-7


