Leucemia promielocítica, el descontrol de una oncoproteína
La leucemia promielocítica aguda, también conocida como leucemia mieloide-3, es un subtipo de la leucemia mieloide aguda. La LPA se caracteriza por promielocitos (una forma de glóbulos blancos) anormales, fuertemente granulados. La condición favorece una acumulación de estos promielocitos atípicos en la médula ósea y la sangre periférica, reemplazando los glóbulos normales. Constituye el 10% de las leucemias mieloides agudas y ocurre usualmente en adultos jóvenes.
El mecanismos de leucemogénesis descrito corresponde a la fusión del gen alfa del receptor de ácido retinoico, RAR-alfa (ubicado en el cromosoma 17) con el gen de la leucemia promielocítica (ubicado en el cromosoma 15), y la enfermedad está específicamente asociada con la translocación a t(15;17). En ausencia de ligando, el RAR-alfa forma heterodímeros con factores transcripcionales en el núcleo inactivando los promotores, en gran medida por reclutamiento de la actividad de la histona desacetilasa que incrementa el enrollamiento de la cromatina. Ello se traduce en un bloqueo en la diferenciación celular (continuando con la proliferación).
El tratamiento de la leucemia promielocítica aguda incluye una quimioterapia de inducción de remisión, seguida por una estrategia consolidativa y de mantenimiento. El factor diferenciador ácido all-trans retinoico (ATRA) ha demostrado ser particularmente eficaz en esta enfermedad en la que proteína de fusión del receptor del gen del ácido retinoico alfa en cromosoma 17 (RAR-alfa) con el gen de leucemia promielocítica en el cromosoma 15 es la característica definitoria más importante. La adición del ATRA ha revolucionado el manejo de esta entidad, convirtiéndola en la variedad más curable de las leucemias mieloides agudas. El nombre genérico del ATRA es Tretinoina.
Leucemia promielocítica aguda
La leucemia mieloide aguda (LMA) implica la inmortalización de los progenitores mieloides inmaduros y es una enfermedad heterogénea. La práctica clínica actual la separa en bajo, intermedio y alto riesgo de acuerdo a las anomalías citogenéticas. Entre los subtipos de bajo riesgo está la leucemia promielocítica aguda (LPA). Aproximadamente, el 98% de las personas con LPA llevan una traslocación en los cromosomas 15 y 17, por lo general como resultado de la fusión de RAR-alfa (receptor alfa del ácido retinoico), que codifica un receptor de ácido retinoico, y la proteína de la leucemia promielocítica (LPM). Estos individuos se tratan con ácido trans-retinoico en combinación con quimioterapia, generando una remisión prolongada en más del 80% de los pacientes. Los casos que tienen una recaída, a menudo, suelen ser tratados con éxito con trióxido de arsénico. Un estudio reciente realizado por Rihab Nasr y colegas (Nat Med 2008; 14:1333-1342) arroja nuevos indicios sobre la forma en que estos agentes pueden controlar la leucemia.
Modelos de cultivos celulares han demostrado que la proteína de fusión LPM-RAR-alfa, así como la proteína de fusión menos frecuente (PLZF)-RAR-alfa dedos de zinc, inhibe la diferenciación de las líneas celulares mieloides. Esta acción se debe al reclutamiento aberrante de factores de transcripción y de enzimas modificadoras de histonas en los genes que normalmente están regulados por el receptor de ácido retinoico (figura 1). Tales genes codifican factores de transcripción que estimulan el desarrollo mieloide y los reguladores del ciclo celular. LPM-RAR-alfa también activa los genes que estimulan la auto-renovación y la perpetuación de células leucémicas, incluidos dos miembros de las vías de señalización intracelular: Notch y Wnt. Las capacidades de la oncoproteína LPM-RAR-alfa libre para fomentar la renovación y bloquear la diferenciación podrían estar disociadas. La leucemia se desarrolla en ratones transgénicos que expresan LPM-RAR-alfa después de un periodo de latencia de hasta 1 año. Antes de entonces, sólo se observa una modesta expansión del compartimiento mieloide, y los promielocitos LPM-RAR-alfa tienen perfiles de expresión génica que son casi idénticos a los promielocitos normales. En segundo lugar, y quizás otras lesiones todavía desconocidas, colaboran con LPM-RAR-alfa para bloquear la diferenciación y estimular la acumulación de los promielocitos malignos y su auto renovación.
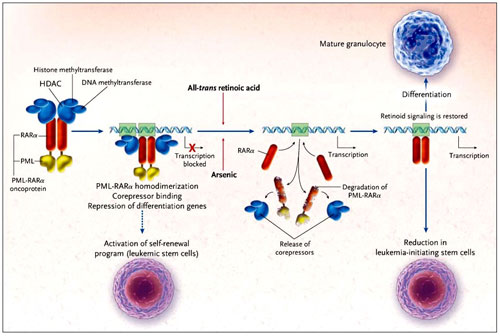
La proteína de fusión LPM-RAR-alfa se une a los genes diana RAR-alfa como un homodímero y recluta la maquinaria de "represión", incluyendo las histonas deacetilasas (HDACs), histonas metiltransferasas y el ADN de metiltransferasas, inhibiendo la expresión de estos genes y la diferenciación celular. El resultado es un bloqueo de la diferenciación en la etapa promielocítica. Genes que codifican proteínas estimuladoras de la auto-renovación del promielocito se activan a través de mecanismos indirectos. La exposición de células de leucemia promielocítica aguda al ácido trans-retinoico o al arsénico restablece la capacidad de diferenciación mediante la liberación de co-represores de la proteína de fusión LPM-RAR-alfa, y - como Nasr y colaboradores demostraron recientemente - por la degradación de la proteína de fusión. La pérdida de LPM-RAR-alfa conduce a una disminución en el número de células de auto-renovación pudiendo reiniciar la leucemia en ratones y, por tanto, ser un aspecto fundamental para prevenir la recurrencia.
La aplicación de ácido trans-retinoico a LPA en células de cultivo que expresan la proteína de fusión LPM-RAR-alfa, y a LPM-RAR-alfa en ratones transgénicos provoca la diferenciación de los promielocitos malignos en los granulocitos maduros. Esta diferenciación se traduce en un número cada vez mayor de células mieloides maduras y de infiltrados pulmonares - el llamado síndrome del ácido retinoico - que se trata con el uso de corticosteroides y quimioterapia concomitante. La utilización de ácido trans-retinoico como agente único en la LPA en general, sin embargo, no da lugar a remisiones duraderas, lo que sugiere que su capacidad para diferenciar promielocitos no es suficiente para eliminar la enfermedad residual. El arsénico puede producir un síndrome de diferenciación LPA, con manifestaciones similares a las del síndrome de ácido retinoico. Ambos agentes pueden reducir la carga leucémica sin el desarrollo de la coagulación intravascular diseminada, y en gran medida la disminución de la mortalidad asociada con el tratamiento en la fase inicial. Aunque los efectos de estas terapias en la diferenciación son necesarias para su éxito, la labor del grupo de R. Nasr indicó que las drogas tienen un efecto adicional: reducen el número de células capaces de regenerar leucemia (conocida como leucemia de células iniciales o leucemia células madre) en ratones.
Utilizando un modelo de ratón, R. Nasr y colegas confirmaron que durante la fase inicial de la terapia de LPA, el ácido trans-retinoico induce un cambio en la actividad de LPM-RAR-alfa, de represor a activador de la transcripción. Este interruptor pone en marcha una onda de diferenciación y, por tanto, la eliminación de una gran fracción de células malignas y, de hecho, del mismo LPM-RAR-alfa. Componentes del proteosoma son utilizados por el dominio dentro de la fracción del receptor de ácido retinoico de LPM-RAR-alfa que se une al ácido trans-retinoico. La diferenciación inducida por el arsénico es generalmente menos pronunciada que la observada en respuesta al ácido trans-retinoico porque el arsénico no activa directamente a LPM-RAR-alfa. Por el contrario, estimula la incorporación de la pequeña molécula SUMO (small ubiquitin-related modifier) a la fracción de LPM de la oncoproteína, marcándola para su degradación. Además, debido a que puede estimular las vías de la quinasa, el arsénico modifica un co-represor crítico de LPM-RAR-alfa, previniendo su interacción con el oncoproteína.
R. Nasr y colegas concluyeron que ni el ácido trans-retinoico solo ni el arsénico eliminan completamente las células iniciales de la leucemia. Más bien, una combinación de estos dos agentes provoca la eliminación de estas células - un efecto de correlación con la degradación y la eliminación de la oncoproteína a partir de células leucémicas. Ya que LPM-RAR-alfa confiere inmortalización y propiedades de auto-renovación celular, la persistencia de una pequeña proporción de células que expresen LPM-RAR-alfa facilitará la recurrencia. En consonancia con este punto está la observación del grupo de R. Nasr de que el ácido trans-retinoico induciría la diferenciación de células leucémicas al albergar la proteína PLZF-RAR-alfa en ratones, pero sería ineficaz en la eliminación de células promotoras de la leucemia y la curación de la enfermedad. Tampoco puede curar seres humanos con leucemia asociada a LPM-RAR-alfa. Que el ácido trans-retinoico no puede, por sí solo, eliminar las células iniciales de la leucemia podría explicar por qué la quimioterapia es añadida a este agente a fin de efectuar la remisión a largo plazo. Otro estudio sugiere que el arsénico es más efectivo que el ácido trans-retinoico en la eliminación celular, potencialmente por su capacidad para inducir remisiones duraderas como agente único en los nuevos diagnósticos de LPA.
Las conclusiones de R. Nasr y colegas son compatibles con los de otros recientes estudios. Colectivamente, estos ensayos replantean el ámbito de la diferenciación de la terapia, el objetivo de que se ha de alterar el fenotipo maligno de la célula, detener la auto-renovación y diferenciación terminal estimulante. Un nuevo modelo debería tener en cuenta las células madre leucémicas, que parecen inmune a la diferenciación, persisten a través de algunas formas de terapia y permiten la recurrencia tumoral. Es necesario, por lo tanto, el tratamiento de la población celular cancerígena y de células madres para que surta efecto a largo plazo la remisión o cura. En el futuro, combinaciones racionales de agentes tales como el ácido trans-retinoico y el arsénico, que efectivamente atacan a las células madre leucémicas, podrían ser utilizadas sin necesidad de la quimioterapia convencional.
Fuente bibliográfica
Acute Promyelocytic Leukemia — Weapons of Mass Differentiation
Jonathan D. Licht, M.D.
Division of Hematology and Oncology, Robert H. Lurie Comprehensive Cancer Center of Northwestern University, Chicago, USA.
N Engl J Med. 2009 Feb 26;360(9):928-30


