EII: y todo por culpa del estrés celular
En eucariotas, las señales que emanan desde el retículo endoplásmico (RE) inducen una transcripción del programa que permite a las células sobrevivir al estrés presentado en el orgánulo. Esta respuesta extremadamente coordinada, “respuesta a proteínas mal plegadas” o UPR, del inglés Unfolded Protein Response, facilita el plegado, el procesamiento, exportación, y la degradación de las proteínas procedentes del RE durante las condiciones estresantes.
Por otra parte, la enfermedad inflamatoria intestinal (EII) ha sido atribuida a una inmunidad aberrante de la mucosa a la microbiota del intestino. Se sabe que el factor de transcripción XBP1, un componente clave del retículo endoplásmico de respuesta al estrés, es necesario para el desarrollo y mantenimiento de las células secretoras y se le ha asociado con la activación de JNK, también conocida como quinasa de proteínas activada por el estrés. La patología intestinal se mantiene en la vanguardia de la investigación en gastroenterología y los últimos hallazgos se traducirán en nuevas estrategias de tratamiento.
Enfermedad inflamatoria intestinal, estrés y el retículo endoplasmático
Las causas de la enfermedad de Crohn y la colitis ulcerosa, son poco conocidas, a pesar de haber sido descrita muchas décadas atrás, principalmente sobre la base de sus manifestaciones clínicas. Experimentos con ratones transgénicos y estudios de asociación de genoma completo en humanos han proporcionado una visión independientemente de la complejidad de las causas genéticas de estos trastornos. Un reciente ensayo descrito por Arthur Kaser y colegas (Cell 2008; 134:743-756) combina enfoques experimentales y genéticos para construir un caso que implicó una respuesta al mal despliegue proteico como culpable de la enfermedad inflamatoria intestinal.
El estrés en el retículo endoplasmático es causado por la acumulación de proteínas nacientes mal plegadas o no plegadas en el lumen celular bajo condiciones adversas. Un proceso de protección activa varias vías de transducción de señales, denominado colectivamente “respuesta a proteínas mal plegadas”. Esta respuesta regula la expresión de los genes que actúan en la vía secretora o interviene el metabolismo de las proteínas y los lípidos. Por lo tanto, remodela la maquinaria secretora y restablece la fisiología celular "despejando la mente" del retículo endoplasmático.
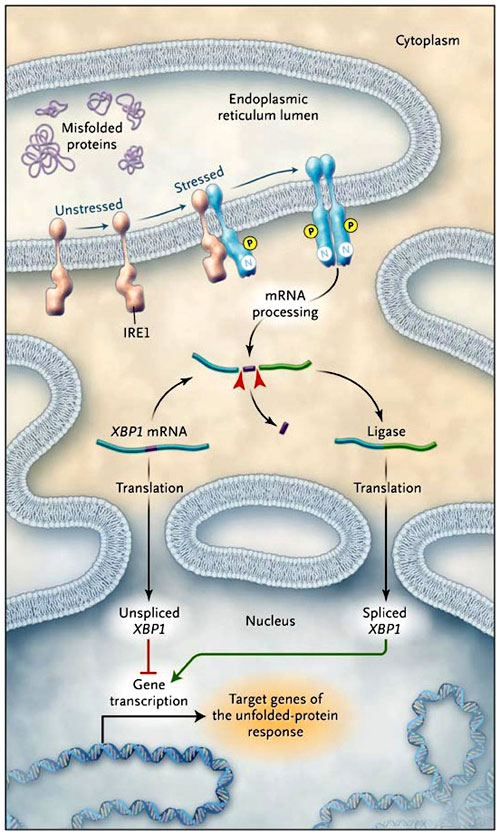
La respuesta a proteínas mal plegadas es iniciada por receptores transmembrana (figura 1). Éstos mantienen la situación de plegado de las proteínas en el retículo endoplasmático y luego transmiten señales a través de sus colas citoplasmáticas. Uno de esos sensores de estrés es la enzima que requiere inositol-1 (IRE1), una proteína transmembrana residente en el retículo endoplasmático que posee un dominio proteinquinasa, así como también actividad endoribonucleasa. IRE1 sufre oligomerización cuando se acumulan proteínas mal desdobladas, lo que provoca su autofosforilación. Esto, a su vez, activa su inusual función efectora: la precisa escisión endonucleolítica del ARN mensajero (ARNm) que codifica un factor de transcripción llamado proteína-1 ligadora de la caja X (XBP1). IRE1 corta el precursor mensajero de XBP1 dos veces, eliminando un fragmento interno y, por tanto, induce un cambio de lectura. Esta actividad tiene un efecto dramático sobre la proteína XBP1 codificada. Considerando que la proteína codificada por el ARNm precursor es lábil y reprime genes diana de la respuesta a proteínas mal plegadas, el empalme de XBP1 con el ARNm es capaz de codificar un estable y potente activador de los mismos genes diana.
Ann-Hwee Lee y colegas (EMBO J 2005; 24:4368-80) previamente habían utilizado técnicas de eliminación de genes para demostrar que Xbp1 es esencial en células con un amplio retículo endoplasmático secretor, como las células plasmáticas y las células epiteliales del páncreas y glándulas salivales. El grupo de A. Kaser, asociado con estos autores y motivados por un informe que señalaba que la supresión genética de un sensor de estrés del retículo endoplasmático exacerbaba la colitis en ratones, generó un ratón con un alelo condicional Xbp1 que pudiese ser extraido únicamente en las células intestinales. Cabría esperar que tales células aumentaran el estrés en el retículo endoplásmico, y esta predicción se vio confirmada. Por otra parte, mutantes Xbp1 de epitelio intestinal presentaban una extensa inflamación, mientras que los linajes de células secretoras estaban ausentes (células de Paneth) o tenían reducido significativamente su número (células caliciformes). No se observó colitis espontánea, sin embargo, los animales presentaron una mayor susceptibilidad a la colitis experimental.
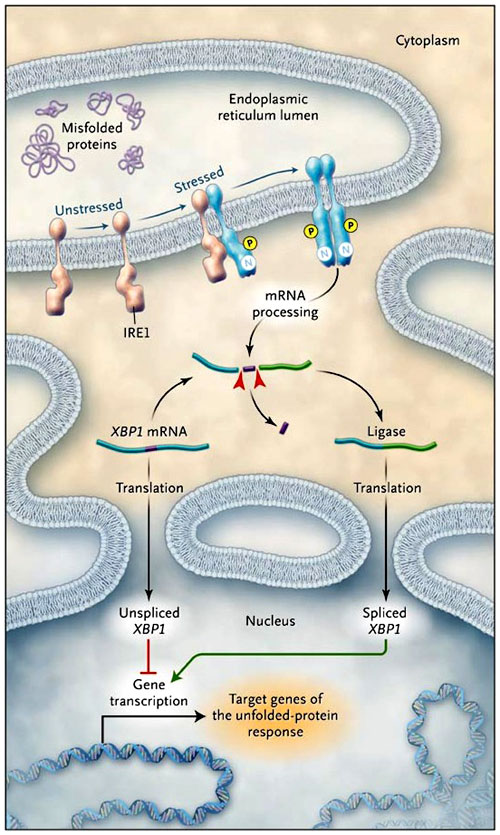
El receptor de la enzima que requiere inositol-1 (IRE1) forma multímeros en la membrana del retículo endoplásmico en células estresadas. Se produce la autofosforilación e IRE1 mediada por una secuencia específica de XBP1 rompe el ARN en pequeños fragmentos. Los dos fragmentos de ARNm se religan, lo que conduce a un cambio en el marco de la secuencia codificadora. La unión XBP1-ARNm codifica para XBP1, un potente activador transcripcional de los genes diana de la respuesta a proteínas mal plegadas, mientras que desunión de XBP1 y ARNm codifica un inhibidor transcripcional. El grupo de A. Kaser recientemente ha generado un modelo murino para la enfermedad inflamatoria intestinal inducible mediante la prevención de esta reacción de empalme y, por tanto, la inactivación de la respuesta a proteínas mal plegadas. Este hallazgo da lugar a la hipótesis de que la integridad del epitelio intestinal depende de la respuesta a proteínas con problemas de plegamiento y que esa respuesta comprometida hace que las personas sean más susceptibles a la enfermedad inflamatoria intestinal. N denota endonucleasa, y P autofosforilación.
Los autores modificaron la enfermedad inflamatoria intestinal y documentaron el aumento de los niveles activados de XBP1-ARNm tanto en tejidos sanos como inflamados, indicativo de un estrés permanente en el retículo endoplásmico de estos pacientes. La combinación de observaciones que implique a los componentes de la vía de respuesta a proteínas mal plegadas, tales como XBP1, podría contribuir a dilucidar la susceptibilidad genética a la enfermedad inflamatoria intestinal. Tres estudios de asociación genética sugieren la vinculación entre la enfermedad inflamatoria intestinal y un lugar en el cromosoma 22q12, donde se encuentra el gen XBP1. A. Kaser y colegas llevaron a cabo tres estudios de asociación, utilizando marcadores genéticos que abarcaban la región 22q12 y muestras de pacientes con enfermedad de Crohn o colitis ulcerosa, además de muestras de sujetos control no afectados. Los investigadores identificaron haplotipos de protección y de riesgo en el locus XBP1.
Posteriormente, ellos aplicaron una "secuenciación profunda" (es decir, la resecuenciación de los elementos esenciales para el gen XBP1) de las muestras procedentes de varios cientos de pacientes con enfermedad de Crohn o colitis ulcerosa y de sujetos control. Se detectaron múltiples polimorfismos, algunos de los cuales eran muy raros, que afectaban a la codificación de la secuencia del gen XBP1, ocurriendo sólo en personas con enfermedad inflamatoria intestinal. Estos polimorfismos fueron demasiado escasos para permitir el análisis estadístico. Sin embargo, cuando dos de las variantes de secuencias de XBP1 fueron probadas funcionalmente, ellas disminuyeron la caída funcional de XPB1 en cultivos celulares.
Otros análisis de asociación genética en pacientes con enfermedad inflamatoria intestinal han revelado más de una docena de genes de riesgo. Algunos de estos genes perturban la inmunidad innata y adaptativa (NOD2 y IL23R, respectivamente), la autofagia (ATG16L1 y IRGM) y la función de barrera del epitelio (DLG5). El estudio de A. Kaser proporciona evidencia genética que implica a otro fenómeno biológico en la causa de la enfermedad inflamatoria intestinal: el estrés del retículo endoplasmático. La confirmación experimental de esta hipótesis puede venir de los estudios en ratones diseñados para expresar los cambios en el gen XBP1 encontrados en algunos pacientes con enfermedad inflamatoria intestinal. El proceso de respuesta a proteínas mal plegadas está altamente conservado y la vía de señalización bien caracterizada. Si, efectivamente, el estrés en el retículo endoplasmático contribuye a la enfermedad inflamatoria intestinal, se prevé que los nuevos estudios descubran componentes adicionales de la vía.
Fuente bibliográfica
Inflammatory Bowel Disease, Stress, and the Endoplasmic Reticulum
Hans Clevers, M.D., Ph.D.
Hubrecht Institute, Utrecht, The Netherlands.
N Engl J Med. 2009 Feb 12;360(7):726-7