Buenas proteínas, buen corazón
Científicos han descubierto una proteína que puede ayudar a proteger el corazón contra el daño isquémico. Aunque la investigación inicial ha sido sólo en modelos de rata, la inyección de la molécula Alda-1 redujo el tamaño del infarto en un 60%, y, si tiene el mismo efecto en los seres humanos, podría ser útil en condiciones como la angina inestable o resguardar al corazón de la isquemia durante la cirugía de "bypass". La gran novedad radica en que antes de llegar a este compuesto, se utilizó por primera vez un enfoque proteómico para identificar nuevas vías que reducen el daño causado por los radicales libres, permitiendo luego la búsqueda de una molécula capaz de modificar importantes enzimas presentes en el camino metabólico.
La proteómica, término introducido en 1995, corresponde al análisis de las proteínas en una muestra de sangre. Por ejemplo, puede ayudar a detectar el cáncer en estadios iniciales o su recurrencia, o a predecir la respuesta a un determinado tratamiento. Basándose en ciertos modelos matemáticos, se han elaborado técnicas que permiten la identificación de proteínas de forma mucho más eficiente. En el área de la cardiología, la cardioproteómica repercutirá en un cambio beneficioso en la práctica de la especialidad, en todos sus aspectos: detección, diagnóstico, manejo y tratamiento. Esto permitirá un pronóstico más favorable de aquellos pacientes con enfermedades tanto agudas como crónicas.
Corazón y proteómica
Che-Hong Chen y colegas (Science 2008; 321:1493-1495) recientemente describieron a la enzima aldehído deshidrogenasa mitocondrial tipo 2 (ALDH2) como un objetivo en la protección del corazón contra el daño isquémico. El estudio proporciona información detallada sobre la biología cardiovascular y puede constituir la base de un posible enfoque terapéutico para prevenir o minimizar las lesiones isquémicas del miocardio en el ámbito clínico.
Las células cardíacas tienen mecanismos de defensa innata contra los efectos negativos de la interrupción prolongada de circulación sanguínea como consecuencia de un ataque al corazón. La presencia de estos procesos originalmente se describió con el descubrimiento de que breves episodios de isquemia y reperfusión protegen al órgano de una isquemia prolongada. Este mecanismo se conoce como precondicionamiento isquémico, procedimiento fundamental para la activación de una molécula de señalización, la proteína quinasa C-épsilon (PKC-épsilon), la cual moviliza un programa de defensa cardíaca endógena y, por ende, tiene un efecto atenuante del infarto.
Este descubrimiento ha estimulado los esfuerzos de investigación intensiva que permitan encontrar agentes farmacológicos que recojan los resultados del precondicionamiento isquémico. Los nitratos, agonistas de la adenosina, y los anestésicos volátiles, que han demostrado ser cardioprotectores en el laboratorio, han suscitado las esperanzas de proteger a los pacientes de los daños del infarto, en particular en clínicas - como en el trasplante y cirugía de derivación - en donde la isquemia puede ser anticipada. Dicho esto, el diseño de estrategias cardioprotectivas experimentales sigue siendo un importante desafío.
Los estudios sobre los mecanismos celulares de la lesión isquémica apuntan cada vez más hacia un papel predominante de las mitocondrias. Éstas, no sólo son los principales productores de energía de la célula cardíaca, también acogen las vías de señalización para la biogénesis y la muerte celular programada. La isquemia miocárdica conduce a un aumento de absorción mitocondrial de Ca2+, que a su vez incrementa la permeabilidad de la mitocondria, lo que lleva a la ruptura de la respiración mitocondrial y, en última instancia, a la muerte celular. Durante el preacondicionamiento, la PKC-épsilon impide este proceso degenerativo mediante la fosforilación molecular desencadenándose una cascada de eventos que preservan la función mitocondrial.
La mitocondria de los mamíferos contiene más de 1500 proteínas distintas, muchas de las cuales tienen diferentes tipos de modificaciones post-translacionales. En lugar de una evaluación molecular individual, un análisis proteómico proporciona una amplia base respecto a los cambios dinámicos en los proteomas mitocondriales durante la isquemia y repercusión, y ofrece un medio eficaz de identificación de las proteínas más relevantes para la enfermedad.
El estudio de C.H. Chen y colegas combina el poder de la proteómica con un clásico modelo animal de infarto de miocardio (figura 1). Los autores señalan que la fosforilación de ALDH2 mitocondrial en respuesta a estímulos de protección (como la activación de PKC-épsilon o el tratamiento con etanol) incrementa la actividad enzimática y reduce el tamaño del infarto de miocardio en modelos animales para la lesión isquémica del miocardio. A continuación, identificaron a Alda-1 como un agonista específico de ALDH2 que activa diferentes isoformas, incluida la codificación de ALDH2*2, un alelo común en la mayoría de las poblaciones en el Este de Asia. Cuando se administra en roedores antes del desarrollo de isquemia con lesión isquémica generalizada, Alda-1 reduce el tamaño del infarto, así como el preacondicionamiento mimético. La activación de ALDH2 por Alda-1 depende de PKC-épsilon.
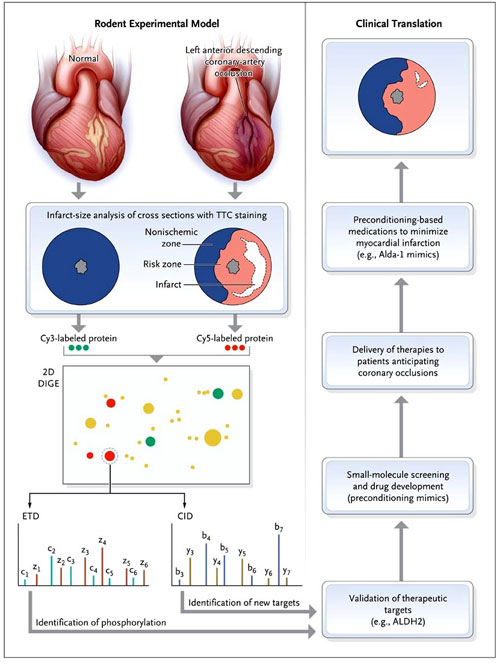
Utilizando un diseño proteómico, Che-Hong Chen y colaboradores analizaron modelos experimentales de lesión al corazón. Los investigadores extrajeron proteínas de corazones de animales que habían sufrido simulacros de operaciones o tenían lesiones isquémicas (corazón dañado) y luego las marcaron con tintes fluorescentes (por ejemplo, Cy3 [verde], y Cy5 [rojo]). Posteriormente, mezclaron las muestras e identificaron las proteínas con cloruro de trifenil tetrazolio (TTC) en una tinción bidimensional en gel de acuerdo con el punto isoeléctrico y peso molecular (por ejemplo, el diferencial de dos dimensiones en la electroforesis en gel [2D DIGE]). Círculos de color amarillo indican puntos de proteínas que son idénticas en el simulacro y en corazones dañados, círculos verdes indican que las proteínas son más frecuentes en el simulacro, y los círculos rojos indican los puntos de proteínas que son más abundantes en el corazón dañado. Las proteínas de interés fueron extraídas del gel, y los iones (c, z, b, e y) se analizaron por medio de cromatografía líquida y espectrometría de masas. Los espectrómetros de masas para la disociación inducida por colisión (CID) fueron preferibles para la identificación de proteínas, mientras que las establecidas para la disociación de transferencia de electrones (ETD) para la identificación de sitios de fosforilación. Candidatos importantes tales como la aldehido deshidrogenasa tipo 2 (ALDH2) se están examinando y validando para el desarrollo de potenciales agentes terapéuticos.
El enfoque proteómico utilizado por el grupo de C.H. Chen para ayudar a traducir las ideas de los estudios de preacondicionamiento al ámbito clínico evita las nociones preconcebidas acerca de las moléculas que están involucradas, permitiendo la identificación de un objetivo molecular clave de preacondicionamiento. Mediante esta perspectiva, con estudios fisiológicos en animales y la detección de pequeñas moléculas, los autores han aportado un nuevo mecanismo con potencial relevancia clínica. Aunque se necesita más investigación de fondo, activadores de ALDH2 pueden en algún momento proteger a los pacientes contra el infarto de miocardio. Incluso la limitación de la restauración de ALDH2 por Alda-1 podría ser muy relevante para la prevención de un infarto de miocardio en personas que llevan el alelo ALDH2*2.
Fuente bibliográfica
Getting to the Heart of Proteomics
Peipei Ping, Ph.D.
National Heart, Lung, and Blood Institute Program Project on Myocardial Ischemia Injury and Protection, David Geffen School of Medicine at UCLA, Los Angeles, USA.
N Engl J Med. 2009 Jan 29;360(5):532-4


