Cuando se cruzan la oncogénesis y la metástasis
Twist1 y Twist2 son los principales reguladores de la embriogénesis. Se ha demostrado que en condiciones patológicas Twist1 favorece la migración metastásica de células cancerosas a través de su capacidad para inducir una transición epitelio-mesenquimal. En este sentido, también se conoce que una gran cantidad de tumores humanos sobre-expresan a Twist1 y/o Twist2, en donde, ambas proteínas anulan la senescencia prematura inducida por los oncogenes a través de la supresión de reguladores clave de las vías dependientes de p53 y Rb (reguladores de la división celular normal). Además, Twist1 y Twist2 cooperan con el gen y las proteínas Ras para transformar a los fibroblastos embrionarios de ratón. Curiosamente, en las células epiteliales, la interacción entre las proteínas Twist y las oncoproteínas mitogénicas activadas, tales como Ras o ErbB2, da lugar a una completa transición epitelio-mesenquimal. Estos hallazgos sugieren una relación directa entre la falla regulatoria de uno más genes específicos y la adquisición de características invasoras de las células cancerosas.
Estos alentadores descubrimientos podrían representar un enorme potencial terapéutico. Si se pudiese desarrollar un medicamento capaz de “apagar” automáticamente el gen Twist en las células cancerosas que lo tienen activado, el tumor no desaparecería pero dejaría de hacer metástasis en tejidos y órganos hasta entonces sanos. Después de esto, con las terapias tradicionales (cirugía, quimioterapia y rayos) se podría eliminar el cáncer primitivo y devolverle al paciente un estado de normal salud.
Oncogénesis y migración metastásica
En general, el tratamiento del cáncer se basa en el grado histológico, resectabilidad y la presencia o ausencia de metástasis. Debido a que las intervenciones después de la manifestación metastásica son notoriamente ineficaces para la mayoría de los cánceres, se han invertido grandes esfuerzos en el desarrollo de terapias dirigidas a erradicar o suprimir el crecimiento de la enfermedad micrometastásica. En tres recientes estudios (Nature 2008;454:49-55, Cell 2008;133:704-715 y Cancer Cell 2008;14:79-89), los investigadores han señalado los posibles objetivos: las proteínas que regulan tanto la transformación como la metástasis. Estos ensayos también ofrecen una posible pista de por qué algunos tipos de cáncer ya han generado metástasis en el momento del diagnóstico.
Las proteínas implicadas, la homólogo 1 de Twist (Twist-1) y dos miembros dedos de zinc de la familia Snail, son factores de transcripción asociados con la transición de un fenotipo epitelial a un fenotipo mesenquimal (transición epitelio-mesenquimal) y la diseminación del cáncer. Los estudios realizados por Tarjei S. Mikkelsen, Sendurai A. Mani y Stéphane Ansieau y colegas señalan que Twist-1 y las proteínas Snail son relevantes para la transformación neoplásica, lo que sugiere que la capacidad metastásica de algunas células cancerosas puede ser adquirida al comienzo de la conversión maligna. Se cree que la capacidad de las proteínas codificadas por TWIST-1, Snail homólogo 1 (SNAI1) y Snail homólogo 2 (SNAI2) para suprimir la expresión de E-cadherina, una potente molécula de adhesión intercelular, es fundamental en estos dos procesos, que implican la migración celular.
Mikkelsen y colegas se preguntaron si las células somáticas pueden ser reprogramadas a un estado pluripotente a través de la expresión ectópica de determinados factores de transcripción. Observaron que la respuesta inmediata a la inducción de los factores de reprogramación se caracteriza por una inversión en la diferenciación de fibroblastos de embriones de ratón y una concomitante sobre-regulación de los genes de proliferación, incluyendo Snai1 y Snai2, que están asociados con la transición epitelio-mesenquimal. En consonancia con estas observaciones, el estudio de Mani y colaboradores informó que la inducción de la transición epitelio-mesenquimal inmortalizó células epiteliales mamarias humanas por expresión ectópica de Twist-1 o Snai1, resultando en la producción de células similares a las células madre, que, a su vez, fueron capaces de generar células madre para el cáncer. Además, el grupo de Mani encontró que las unidades similares a las células madre aisladas de glándulas mamarias de ratón y humano y de carcinomas expresaban marcadores para la transición epitelio-mesenquimal. Estos resultados sugieren que tal transición puede contribuir a la transformación celular. El estudio de Ansieau y colaboradores amplió el alcance de la transición epitelio-mesenquimal aún más, al demostrar que el factor de transcripción Twist-1 puede proteger a las células de la senescencia inducida por el oncogén Ras.
El modelo clásico de desarrollo del cáncer propone que los factores de transcripción implicados en la promoción de la transición epitelio-mesenquimal están activados en las células cancerígenas que residen en el borde invasivo del cáncer avanzado. Según este modelo, la activación de las proteínas asociadas con la transición epitelio-mesenquimal no ofrece una ventaja de crecimiento en el tumor primario, sino más bien, media el último paso en la progresión tumoral (es decir, la metástasis). En contraste, los resultados de los tres estudios indican que la diseminación metastásica se produce continuamente a lo largo del curso de desarrollo del tumor primario, por lo menos en algunos tipos de cáncer (figura 1).
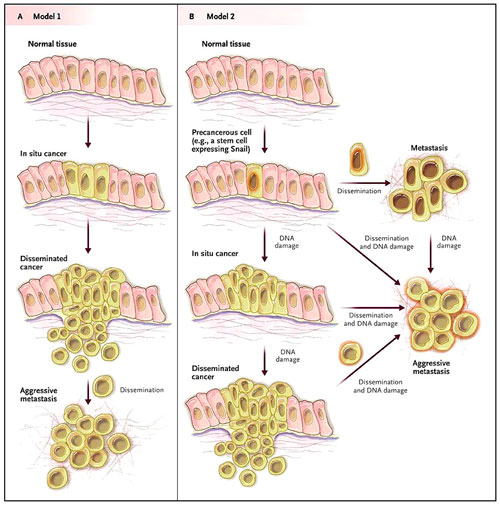
En el modelo clásico para el desarrollo del cáncer en humanos, las metástasis corresponden a la etapa final de la cascada tumorígena (panel A). Sin embargo, estudios recientes apoyan un modelo diferente, que predice que la expresión de proteínas que regulan la transición epitelio-mesenquimal promueve la conversión maligna concomitantemente con la diseminación metastásica (panel B). En este modelo alternativo, la difusión celular del tumor primario se puede producir en cualquier momento durante el desarrollo del cáncer.
La expresión de las proteínas Snail se reprime en respuesta a lesiones del ADN, alimentando la hipótesis de que esta represión es una defensa fisiológica contra la tumorigénesis. Entonces, los resultados apoyan la idea de que las proteínas Snail regulan las vías moleculares que promueven la invasión de las células tumorales. Así pues, en condiciones fisiológicas, el daño del ADN disminuye la expresión de las proteínas Snail y, probablemente, inhibe o contribuye a la inhibición de la capacidad migratoria de las células tumorales. La expresión constitutiva de proteínas Snail durante la transformación podría impedir este control. La expresión de proteínas implicadas en la transición epitelio-mesenquimal, incluyendo a Snai1 y Snai2, se asocia con la recidiva tumoral en los pacientes y un mal pronóstico en una variedad de tipos de cáncer. Por lo tanto, es posible que la detección de la expresión de estas proteínas sea capaz de identificar a los pacientes que puedan beneficiarse de una quimioterapia más agresiva o de otros esquemas terapéuticos.
La necesidad de modelos de ratón más precisos para el cáncer representa un obstáculo que se encuentra entre los estudios de este tipo, y el éxito pasa por encontrar una estrategia terapéutica racional. También es importante identificar represores endógenos de la migración con el fin de entender cómo se puede detener la migración de las células cuando llegan a los tejidos diana. El desarrollo de inhibidores que interfieran específicamente con la delaminación celular de los tumores primarios es también un importante objetivo. La inactivación de las proteínas implicadas en la transición epitelio-mesenquimal podría frenar la invasión celular y hacerlas más susceptibles a la destrucción. Sin duda, una hipótesis sería dirigir agentes a tales proteínas para encontrar el talón de Aquiles en al menos algunas formas de cáncer humano.
Fuente bibliográfica
The Crossroads of Oncogenesis and Metastasis
Isidro Sánchez-García, M.D., Ph.D.
Experimental Therapeutics and Translational Oncology Program, Instituto de Biología Molecular y Celular del Cáncer, Consejo Superior de Investigaciones Cientificas-Universidad de Salamanca, Salamanca, Spain.
N Engl J Med. 2009 Jan 15;360(3):297-9


