Reprogramando células para hacer insulina
Ciento treinta y dos millones de personas padecen diabetes en todo el mundo. La diabetes mellitus tipo 2, que representan más del 90% de los casos, se caracteriza por resistencia a la acción de la insulina, la hormona que controla los niveles de glucosa en la sangre. Por su parte, la diabetes tipo 1, antes conocida como diabetes juvenil, es una enfermedad autoinmune en donde las células T destruyen las células beta productoras de proinsulina e insulina en el páncreas.
En ambas condiciones, la insuficiente cantidad de hormona generada por las células beta es importante causa del control defectuoso de la glucosa en la sangre y sus complicaciones. En consecuencia, las terapias que puedan aumentar la masa y funcionalidad de las células beta ofrecerán una posible cura para la diabetes. Los esfuerzos para lograr este objetivo están evaluando varias direcciones. Sobre la base de la comprensión de que las células beta son capaces de proliferar significativamente a través de la vida adulta, su mayor crecimiento in vivo o in vitro se utiliza como una estrategia para la medicina regenerativa en la diabetes y en otras enfermedades humanas. Alternativamente, se está intentado realizar la conversión de células diferenciadas, como hepatocitos en células beta, mediante mecanismos moleculares transcripcionales. También se han realizado avances en la dirección de la diferenciación de células madre embrionarias en células beta. Aunque el progreso es alentador, aún existen grandes vacíos respecto a la comprensión de la biología del desarrollo del páncreas y de las células beta adultas que impiden una aplicación terapéutica posible.
Promoviendo el número de células beta
El restablecimiento funcional de las células beta mediante terapia celular posiblemente es la opción actual más realista para curar la diabetes mellitus tipo 1. El trasplante de células de islotes humanos ha sido objeto de ensayos clínicos, pero el procedimiento suele excluirse a priori de la aplicación rutinaria debido a la escasez de donantes, a partir de los cuales se obtienen las células destinadas a los trasplantes. En consecuencia, existe una urgente necesidad de fuentes alternativas de células beta.
Respecto a lo anterior, es alentador un reciente estudio realizado por Qiao Zhou y colegas (Nature 2008; 455:627-632). Estos investigadores informaron del éxito de la "reprogramación" de células acinares exocrinas del páncreas de ratones adultos en células beta productoras de insulina. Esta transformación se logró por la inyección en el páncreas de los animales de un grupo de tres construcciones virales, cada una codificadoras de los factores de transcripción de desarrollo Pdx1, Ngn3 y MAFA.
Los autores reconocen la inspiración en los avances realizados con células madre pluripotentes. Este enfoque implica la inducción de unidades completamente diferenciadas, tales como los fibroblastos, para adquirir características similares a las de las células madre embrionarias. La inducción es causada por la transducción retroviral con factores de transcripción. La inducción de células acinares a células beta, sin embargo, no parece requerir necesariamente un paso intermedio representado por la inducción de células madre pluripotentes, posiblemente debido a que la ontogénesis de las células acinares y de las células beta son similares (figura 1). Esto podría deberse a la rápida y eficaz tasa de conversión observada por el grupo de trabajo de Q. Zhou: las primeras células productoras de insulina aparecieron 3 días después de la transducción, y más del 20% de las células transducidas se desarrollaron dentro de las células beta (por lo general, la generación inducida de células madre pluripotentes tarda 2 a 3 semanas, con una eficiencia del 0,1% o menor). Debido al cambio diferenciado de un fenotipo a otro (un proceso descrito como "transdiferenciación"), el cual no involucra la activación de la célula o el ciclo de dediferenciación, este enfoque probablemente tiene un menor riesgo de formación de tumores en comparación a uno que involucre la inducción de un tipo de células pluripotentes auto-renovables.
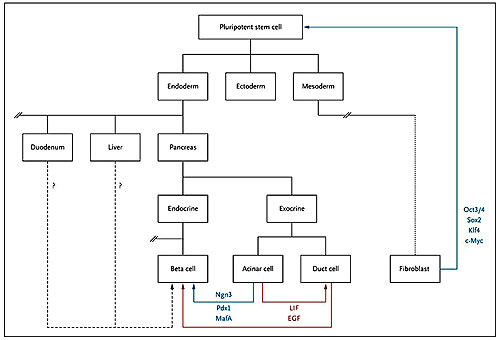
Las células de las tres capas germinales (el endodermo, mesodermo y ectodermo) se derivan de una célula madre pluripotente. Las unidades totalmente diferenciadas, como los fibroblastos, pueden ser inducidas para adoptar el fenotipo de células madre pluripotentes después de la expresión ectópica de los factores de transcripción Oct3/4, Sox2, Klf4 y c-myc. El linaje endodérmico da lugar al intestino, hígado, páncreas y otros órganos que se forman a lo largo del conducto intestinal primitivo. Los progenitores pancreáticos de desarrollan a partir de células exocrinas y endocrinas. El reciente estudio realizado por Q. Zhou y colaboradores demostró en vivo la transdiferenciación de células acinares en células beta a través de la introducción de tres factores de transcripción de desarrollo, Ngn3, Pdx1 y MafA. Otros estímulos de conversión de la célula acinar a célula beta in vitro es el cultivo en un medio complementado con el factor inhibidor de la leucemia (LIF) y el factor de crecimiento epidérmico (FEAG), lo que ocurre a través de un conducto celular intermediario.
Previamente, ya se había informado de una posible alternativa a la inducción de células beta sin la introducción de material genético. Células acinares aisladas de su microambiente en el páncreas de rata recibieron una combinación del factor inhibidor de la leucemia y el factor de crecimiento epidérmico. La exposición in vitro de las células acinares a estos factores solubles resultó en la conversión a células beta funcionales. El trasplante de estas unidades a ratones diabéticos dio lugar a la normalización. Zhou y colaboradores también llevaron a cabo una prueba del efecto terapéutico y encontraron que la transdiferenciación inducida de células acinares en células beta era suficiente para mejorar pero no normalizar la glucemia de los animales cuyas células beta habían sido suprimidas por la toxina estreptozocina. Dado que los niveles de azúcar en la sangre de estos ratones fueron examinados por sólo 2 meses, no se analizó la estabilidad a largo plazo y la funcionalidad de las células transdiferenciadas.
Aunque a algunos investigadores han señalado que es preferible la transdiferenciación de células acinares adultas en células beta en vez de la utilización de células madre embrionarias en el tratamiento de la diabetes tipo 1, varios obstáculos tienen que ser dilucidados antes que el estudio de Zhou y colegas pueda extrapolarse al tratamiento de la diabetes. Existen muchos riesgos posibles durante la manipulación genética in vivo. Tales peligros pueden prevenirse o, al menos, ser evaluados cuidadosamente mediante la manipulación de células en cultivo. De hecho, sería un requisito un control de calidad meticuloso de las células transdiferenciadas in vitro antes de realizar ensayos en pacientes. Por otra parte, es necesario contar con alternativas para la transducción de células por virus recombinante debido a la falta de control de la expresión del transgén (y, en particulares tipos de virus, su asociación con mutagénesis insercional y, por tanto, la iniciación del tumor). Se han invertido grandes esfuerzos en el desarrollo de transportadores no virales para la eficaz y concreta entrega de moléculas en las células. Por lo tanto, existen buenos y esperanzadores motivos para que este reto se concrete a la brevedad. Una ventaja adicional del proceso de células in vitro - en contraposición a la inducción de transdiferenciación in vivo de células acinares en células beta – debería ser un mayor grado de control del número de células beta funcionales recién formadas para el injerto.
Por último, como el equipo de Zhou señaló, las células de origen endodérmico tales como hepatocitos y las células intestinales son más accesibles y abundantes que las células acinares. En caso de que los obstáculos técnicos descritos anteriormente sean superados, estas unidades deberán ser consideradas como una fuente de células beta en los trasplantes.
Fuente bibliográfica
Boosting Beta-Cell Numbers
Harry Heimberg, Ph.D.
Diabetes Research Center, Vrije Universiteit Brussel, Brussels
N Engl J Med. 2008 Dec 18; 359(25):2723-4


