Mastocitos: el alimento del cáncer de páncreas
El adenocarcinoma de páncreas se caracteriza por tener un estroma desmoplásico denso y rico en fibras colágenas, matriz extracelular de proteínas, fibroblastos y células inflamatorias. Recientes estudios han analizado la relación entre las células tumorales y el estroma circundante en el cáncer de páncreas, demostrando la existencia de distintos compartimentos espaciales de expresión génica que conducen a la creación de una especie de interferencias entre las células del tejido conectivo y las células cancerosas. Según estas investigaciones, las moléculas relacionadas con la respuesta inmune, como las inmunoglobulinas, son selectivamente sobre-expresadas en el estroma tumoral. Este hecho apoya la existencia de una respuesta inmune antitumoral ejercida por las células inflamatorias que pueblan el área peri-tumoral del tejido conectivo. Sin embargo, las células inflamatorias pueden tomar parte en el proceso de invasión tumoral: las células tumorales producen citoquinas y factores de crecimiento que promueven el crecimiento de fibroblastos, provocando efectos quimiotácticos sobre las células inflamatorias, lo que a su vez aumenta la síntesis de citoquinas, los factores de crecimiento y factores pro-angiogénicos que contribuyen a la progresión del cáncer. Además, la infiltración de células inflamatorias en un determinado sitio del organismo puede preceder al desarrollo de una neoplasia y una condición inflamatoria pre-existente, con frecuencia infecciosa, pudiendo estar involucrada en la génesis patológica de muchos tumores malignos.
También es sabido, que los mastocitos con frecuencia se acumulan en los tumores humanos y tienden a concentrarse en las fronteras del tumor. Una relación entre el número de mastocitos y la capacidad invasiva de las células tumorales se ha descrito en melanomas, en el cáncer de pulmón y en los carcinomas de esófago, estando relacionada principalmente con la producción de factores pro-angiogénicos para los mastocitos.
Mastocitos como modelo en el adenocarcinoma ductal pancreático
El adenocarcinoma ductal pancreático es probablemente el más letal de los cánceres, con una media de supervivencia menor a los 6 meses y una tasa de sobreviva de 5 años en menos del 5% de los enfermos. Su causa es desconocida, y este tipo de cáncer se resiste a todos los tratamientos actualmente disponibles. El aumento de las evidencias indica que la inflamación alrededor de los tumores, entre ellos la infiltración de mastocitos (también llamadas células cebadas), facilita el crecimiento neoplásico, especialmente el del adenocarcinoma ductal pancreático.
Los mastocitos derivan de un único precursor de la médula ósea y maduran en los tejidos. Por lo general, son conocidos por su papel en reacciones alérgicas y anafilácticas, durante el cual se secretan numerosas moléculas inflamatorias vasoactivas y quimioatractantes, así como factores de crecimiento. Además de los elementos desencadenantes alérgicos, los mastocitos participan en la inflamación, ya que pueden ser activados por factores no alérgicos (figura 1), muchos de los cuales son expresados por las células del adenocarcinoma ductal pancreático.
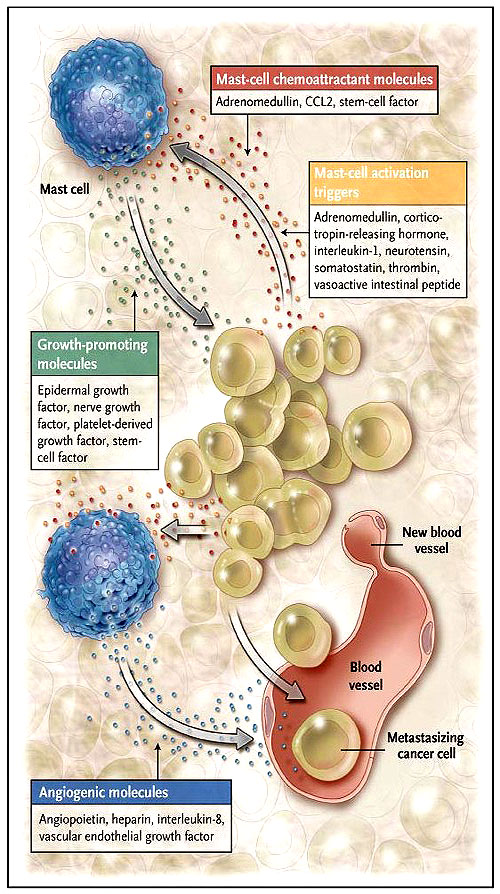
El cáncer de páncreas segrega quimioatractantes que reclutan a los mastocitos en sus cercanías. Estas células son activadas por contacto directo o por factores desencadenantes provenientes del cáncer para la liberación selectiva de mediadores "pro-cáncer". Estos mediadores inducen la angiogénesis, promueven la proliferación tumoral, inhiben la respuesta inmune y rompen el estroma circundante para permitir la metástasis. CCL2 denota al ligando 2 de la quimiocina.
Laura Soucek y colaboradores (Nat Med. 2007 Oct; 13(10):1211-8) reportaron que la activación de la proteína del oncogén Myc en ratones induce un rápido desarrollo tumoral de los islotes pancreáticos que depende de la incorporación de mastocitos. Myc es un factor de transcripción pleiotrópico que contribuye a la angiogénesis del tumor, crecimiento, proliferación y la remodelación del estroma. Soucek y sus colegas observaron que la rápida activación de Myc (dentro de las 24 horas) induce la liberación de mastocitos quimioatractantes, en particular, el ligando 2 de la quimiocina (CCL2, también conocida como proteína quimioatrayente de monocitos 1) en el estroma del islote. En esta primera fase, los mastocitos son las únicas células inflamatorias que crecen en las proximidades de las células tumorales y su infiltración se correlaciona con la expansión tumoral en los islotes. Su presencia también es necesaria para el mantenimiento del tumor en el modelo animal. El tratamiento de los ratones con mastocitos estabilizados con cromoglicato disódico (cromolina) llevó a la hipoxia y a la apoptosis del tumor. Por otra parte, los tumores no pueden ser inducidos en ratones deficientes de mastocitos. La activación de Myc no se vio afectada, lo que indica que la ausencia de mastocitos, en lugar de una función aberrante de Myc, impide el crecimiento de tumores pancreáticos. Los autores entonces demostraron que la falta de crecimiento neoplásico en ratones deficientes en mastocitos se debió a un defecto en la angiogénesis tumoral.
En resumen, Soucek y colaboradores demostraron que la activación Myc conduce rápidamente al reclutamiento de las células cebadas a través de CCL2, que los mastocitos son necesarios para la angiogénesis y el crecimiento de tumores pancreáticos, y su inhibición es suficiente para dar lugar a la muerte del tumor. Sin embargo, no identificaron el tumor derivado de los mastocitos estimulados, ni reconocieron las células derivadas de las moléculas que están involucradas en la angiogénesis tumoral. Como la cromolina bloquea la degranulación de los mastocitos y la secreción de mediadores en la mayoría de los ratones, es difícil determinar qué mediadores podrían estar involucrados en el crecimiento tumoral en los islotes por la inducción de Myc. Los autores concluyen que los mastocitos son necesarios para la angiogénesis del tumor y el mantenimiento vascular, sugiriendo además que la inhibición de la función celular puede resultar terapéuticamente útil para restringir el crecimiento del cáncer pancreático.
Muchos mediadores podrían ser considerados "pro-tumores" (figura 1), incluyendo la heparina, metaloproteinasas, el factor de crecimiento derivado de plaquetas y factor de crecimiento endotelial vascular (VEGF). Sin embargo, los mastocitos también liberan moléculas que pueden participar en la muerte del tumor y ser considerados "antitumorales". En consecuencia, la activación de Myc puede conducir no sólo al reclutamiento de los mastocitos, sino también a la secreción selectiva de mediadores angiogénicos como el VEGF.
Lamentablemente, a pesar de que la cromolina inhibe a los mastocitos en ratones, es un inhibidor débil de la secreción en humanos y es mal absorbida, por lo que es poco probable que sea eficaz en el tratamiento del cáncer de páncreas. De hecho, no hay bloqueadores de mastocitos clínicamente eficaces. Sería muy beneficioso tener acceso a estos inhibidores capaces de bloquear la secreción de mediadores pro-tumorales, permitiendo al mismo tiempo la secreción de mediadores antitumorales. Además, también sería favorable si los inhibidores de este tipo podrían orientarse a los mastocitos que sólo están vinculados a las moléculas que reconocen marcadores de superficie celular exclusivas de las células cebadas. Su administración podría estar indicada en pacientes con adenocarcinoma ductal pancreático para permitir concentraciones terapéuticas y reducir los posibles efectos adversos.
El nombre "mastzellen" (derivado de la palabra griega "masto", que significa "para alimentar") fue elegido por el doctor Paul Ehrlich en 1887 para su tesis doctoral. Puede resultar que este término haya sido algo profético, al menos, para la alimentación del tumor: ahora está claro que los mastocitos pueden promover la neoangiogenesis y el crecimiento de los tumores.
Fuente bibliográfica
Mast Cells and Pancreatic Cancer
Theoharis C. Theoharides, Ph.D., M.D.
Tufts University School of Medicine and Tufts Medical Center, Boston, USA.
N Engl J Med. 2008 Apr 24;358(17):1860-1


