Inmunosupresión química: ¿amiga o enemiga?
En la diabetes tipo 1, el sistema inmunológico produce anticuerpos que destruyen por error a las células beta de los islotes pancreáticos; estas unidades tienen la función de identificar la cantidad de azúcar que hay en la sangre, liberando la insulina necesaria para mantener el nivel normal de glucosa. En las últimas décadas se han realizado grandes progresos para el control y tratamiento de esta enfermedad crónica, desde los preparados de insulina y los sistemas de administración de la misma, hasta los avances de laboratorio que permiten y facilitan el control de la glucemia y las cetonas. Si bien no existe una cura específica, se mantienen los esfuerzos por contar con manejos curativos, accesibles y seguros, en las diferentes compañías farmacéuticas e instituciones de salud alrededor del mundo.
Nuestra comprensión de los factores determinantes de la masa de tejido durante la vida adulta es aún rudimentaria. Conocimientos sobre este problema pueden sugerir nuevos enfoques para el tratamiento de condiciones neoplásicas así como también para enfermedades degenerativas. En el caso del páncreas, elucidar los mecanismos que rigen el control de las células beta será importante para el diseño de terapias regenerativas tanto de la diabetes tipo 1 como la de tipo 2, enfermedades caracterizadas por una insuficiente cantidad de células beta. Es evidente que este tipo de células aumenta durante el embarazo y en los estados de resistencia a la insulina, pero las pruebas sobre su capacidad de regeneración en un trauma grave de carácter diabético son aún conflictivas.
Considerando que la diabetes autoinmune es normalmente irreversible, los recientes ensayos en seres humanos y roedores señalan que la función de las células beta (es decir, la producción de insulina y el mantenimiento de la homeostasis de la glucosa), en parte puede recuperarse si se bloquea la autoinmunidad. Sin embargo, la mayoría de los estudios no han evaluado directamente la regeneración de las células beta.
Inmunosupresión química y trasplante de islotes
La diabetes mellitus insulino dependiente (tipo 1), es una patología autoinmune causada por la destrucción selectiva de células beta pancreáticas por los linfocitos T CD4 + y CD8 + autorreactivos. La inducción de una efectiva y sostenida regeneración de estas unidades representa el “santo grial” de la terapia para la enfermedad. ¿Pero se comprende correctamente esta idea?
Un estudio de Tomer Nir y colegas (J Clin Invest 2007; 117:2553-61.) sugiere que la respuesta a esta pregunta fundamental es positiva. Los autores basan su investigación en un modelo experimental de ratón con un transgen que conduce la expresión de una célula beta "tóxica" con la toxina de la difteria (DTA). Con este modelo, demostraron que la regeneración masiva de células beta conduce a la normalización de la homeostasis de la glucosa y a la siguiente destrucción espontánea del 70-80% de las mismas células. También pusieron de manifiesto que el proceso de regeneración se basa principalmente en la proliferación de las restantes células beta y no en la diferenciación de células precursoras. Motivo de preocupación, desde el punto de vista clínico, fue la segunda observación del equipo: que tal proliferación espontánea se bloquea por el uso de agentes inmunosupresores químicos convencionales, como el tacrolimus y el sirolimus, medicamentos que se utilizan habitualmente en el trasplante de islotes, impidiendo el retorno a una glucemia normal (figura 1).
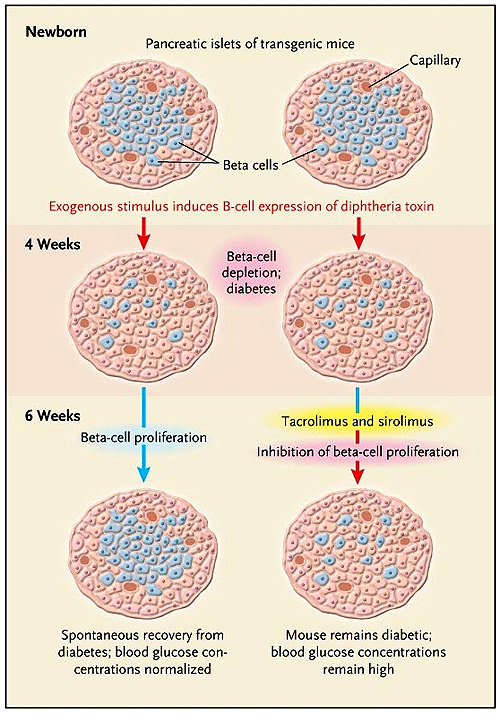
Nir y colegas demostraron que agentes inmunosupresores químicos convencionales, como tacrolimus y sirolimus, impiden la proliferación espontánea de células beta, la que se producía en ratones normales después de la ablación del 70 al 80% de la masa celular beta. La supresión de estas unidades se realizaba en animales diseñados para albergar un transgen codificante para la toxina de la difteria, con lo cual la expresión se inducía por estímulo exógeno. Después de la ablación beta, un tratamiento combinado con tacrolimus y sirolimus, administrados durante un período de 14 días, impidió el restablecimiento de las células beta y la mejora de la diabetes.
¿Deberíamos, por tanto, reconsiderar las estrategias terapéuticas que actualmente se utilizan en el trasplante clínico de islotes? Es importante distinguir entre las condiciones en las que las células beta se someten a una lesión no inmunológica mediada por un tóxico, al igual que en el estudio realizado por Nir y colaboradores, y aquellas en las que son sometidas a un ataque autoinmune, como en la diabetes tipo 1.
En pacientes con diabetes tipo 1, el daño pancreático no es causado por químicos de toxicidad aguda, sino más bien por la inflamación crónica y la destrucción llevada a cabo por células inmune. No obstante, en ambos casos experimentales y clínicos, hay algunas pruebas de que la inflamación inmunológica impulsa la proliferación de células beta. Por ejemplo, las secciones pancreáticas de los pacientes con diabetes tipo 1 contienen algunas células beta, incluyendo muchas que están en apoptosis. La presencia residual de células beta en curso a pesar de la apoptosis sugiere que se produce algún tipo de replicación celular. Sin embargo, la replicación de células beta, según tinción para la insulina y el índice de proliferación del marcador ki67, es poco frecuente.
Los ratones diabéticos no obesos (DNO) que desarrollan una forma espontánea de diabetes autoinmune tienen una modesta proliferación de células beta en los islotes que son infiltrados con linfocitos durante la fase avanzada de la enfermedad. En el inicio de la condición, las células beta residuales representan alrededor del 30% de los valores control, mientras que la secreción de insulina se reduce en mayor proporción en comparación a la masa de unidades beta. Esta discrepancia se explica por la observación de que la destrucción de células beta es precedida por una fase de deterioro funcional de una parte importante de células beta y que es rápidamente revertida cuando la insulitis (es decir, la infiltración de los islotes por células mononucleares) se cura. Por lo tanto, agentes como los anticuerpos monoclonales anti-CD3 que rápidamente sanan la insulitis inducen el retorno a la normalidad el control metabólico de la glucemia en ratones DNO dentro de pocos días después de la aplicación. En consonancia con este hallazgo, la recuperación funcional (según la expresión del transportador 2 de la glucosa y la insulina, específica para células beta) preexiste antes que las mismas células beta en los ratones diabéticos que son tratados con anticuerpos monoclonales anti-CD3. Por consiguiente, el control metabólico y el efecto terapéutico parecen depender de la fuerza funcional, así como de concentración celular beta.
Una cuestión fundamental sobre la capacidad de las células beta para reproducirse es la edad. Los animales de más edad sometidos por el grupo de T. Nir a la destrucción de células beta por DTA tenían 4 semanas. Teniendo en cuenta que el promedio de vida de un ratón es de unos 20 meses y la diabetes en animales DNO se produce entre las 12 y 40 semanas de edad, sería interesante ver si los resultados que se muestran también podrían ser obtenidos en animales más longevos.
En el contexto clínico del trasplante de islotes pancreáticos, los islotes alogénicos implantados en pacientes con diabetes tipo 1 de largo tiempo son blancos de respuestas autoinmune y aloinmune. Esto, combinado con el daño inmunológico, puede conducir a la limitación de la proliferación celular beta. Si los posibles efectos perjudiciales de los inmunosupresores químicos convencionales sobre la proliferación de células beta son ciertos, la terapia debe ser equilibrada con el efecto beneficioso de la prevención o el control de una reacción inmune agresiva. No obstante, el estudio realizado por Tomer Nir y colaboradores debería alentar con rapidez la aplicación de una amplia variedad de agentes biológicos (tales como anti-CD20, anti-CTLA4 y anticuerpos anti-CD3), que no vayan a interferir con la proliferación de las células beta y promover la tolerancia inmune.
Fuente bibliográfica
Chemical Immunosuppression in Islet Transplantation — Friend or Foe?
Lucienne Chatenoud, M.D., Ph.D.
Université Paris Descartes and INSERM Unité 580, Paris
N Engl J Med. 2008 Mar 13; 358(11):1192-3


