¿Cómo convertir el plomo en oro?
Las células madre embrionarias (CME) son capaces de crecer indefinidamente al tiempo que mantienen su pluripotencia y la capacidad para diferenciarse. Varios factores de transcripción están relacionados con el mantenimiento de la pluripotencia, y algunos genes tumorales sin control están asociados con el mantenimiento a largo plazo del fenotipo de las CME y su capacidad de proliferación. Las células pluripotentes son las verdaderas células madre ya que son capaces de derivar en cualquier célula del cuerpo a excepción de membranas extraembrionarias. Se han descrito tres tipos de pluripotentes: células madre embrionarias, células embrionarias germinales y células embrionarias cancerosas.
Recientemente, en un conjunto de tres documentos, dos equipos separados publicaron la posibilidad de transformar células de piel humana en células que son prácticamente indistinguibles de las células madre de embriones humanos. Esto podría proporcionar una forma de generar todo tipo de tejidos, lo que haría más fácil el estudio de enfermedades con componentes genéticos y, tal vez, generar tejidos de reemplazo que no serían rechazados por el sistema inmunológico de las personas.
En uno de estos estudios, los investigadores Takahashi y Yamanaka de la Universidad de Kyoto, analizaron los factores cruciales para la inducción de la pluripotencia. Con este fin, primero seleccionaron 24 genes candidatos, y transfectaron fibroblastos embrionales de ratón con estos genes en el locus Fbx15. La transfección de los 24 genes generó resistencia a G418 (resistencia a neomicina), en contraste con la utilización de genes individuales solos. A continuación, evaluaron cuáles de estos genes son individualmente fundamentales, encontrando que Oct3/4, Klf4, Sox2 y c-Myc son relevantes para generar la inducción de las células madre pluripotentes. La pluripotencia de los clones obtenidos se evaluó por vía subcutánea para formar teratomas. La histología, la inmuno-tinción y la PCR-RT confirmaron que algunos clones se diferenciaron dentro de las tres capas germinales sin expresar marcadores trofoblásticos. La pluripotencia se confirmó mediante el cultivo de clones. Los experimentos fueron repetidos usando fibroblastos de ratón adulto, y de nuevo los mismos cuatro factores generaron la producción de células pluripotentes.
Estos interesantes resultados representan un gran avance respecto a la diferenciación in vitro de las células madre.
Nuevos horizontes para la terapia con células madre
El uso potencial de células madre para la medicina regenerativa y para el tratamiento de la enfermedad genética rara vez ha estado fuera de actualidad. El debate se ha centrado principalmente en la utilización de células madre de embriones humanos que en cultivo tienen la capacidad de generar todos los tipos celulares. Sin embargo, las esperanzas iniciales de la terapia se han diluido en parte por la técnica y los problemas éticos. Los recientes estudios han generado un gran entusiasmo. Éstos demuestran que las células somáticas totalmente diferenciadas (como los fibroblastos de piel) pueden ser reprogramados para transformarse en células similares a las células madre embrionarias, denominadas células madre pluripotentes inducidas. Ahora, Jacob Hanna y colaboradores (Science. 2007 Dec 21; 318(5858):1920-3) han realizado un importante paso demostrando, por la corrección de un modelo murino para la enfermedad de células falciformes, como este tipo de células podrían eventualmente ser utilizadas para curar una enfermedad humana.
La anemia de células falciformes es una de las más comunes anemias heredadas. Aproximadamente 1 de cada 500 personas de ascendencia africana la padecen, y también se ha descrito con frecuencia en individuos de la India, del Oriente Medio y de algunas regiones del Mediterráneo. La alteración se debe a la sustitución del ácido glutámico por valina en la posición 6 de la cadena beta de la hemoglobina (B Glu6Val). Las manifestaciones clínicas surgen de la tendencia de la hemoglobina falciforme (también conocida como hemoglobina S [HbS] o 2 alfa beta S2) a polimerizarse por la presión del oxígeno en reducción y la característica deformación de los glóbulos rojos, la forma rígida de las células falciformes. Tales unidades inflexibles no pueden realizar la microcirculación de manera eficiente, lo que resulta en una anemia hemolítica crónica y una vaso-oclusión intermitente, que afecta a una amplia variedad de órganos. El curso clínico es muy variable, pero a menudo son las complicaciones las que amenazan la vida.
Cincuenta años de intensa investigación han tenido un decepcionante efecto sobre el manejo clínico de la enfermedad. La única cura es el trasplante de médula ósea (células progenitoras hematopoyéticas), que puede legítimamente ser llamado en los adultos terapia de células madre. Hasta la fecha, aproximadamente 250 pacientes con anemia de células falciformes han sido tratados mediante trasplante de células madre hematopoyéticas que han involucrado células progenitoras donadas por un hermano con HLA (acrónimo inglés de Human leukocyte antigen) idéntico. Este enfoque está actualmente reservado para aquellos con enfermedad grave, la tasa de supervivencia libre de enfermedad es del 85%. Las principales cuestiones que restringen el uso de células madre de un donante de antígenos leucocitarios humanos son los aspectos inmunológicos y de cómo el paciente podría soportar sus propias células somáticas (tales como los fibroblastos de piel) mediante reprogramación para la transformación a células madre hematopoyéticas, el equivalente biológico de un sueño alquimista: convertir plomo en oro.
El primer acercamiento para tratar esta reprogramación fue ingenioso, pero complicado. Se trataba de eliminar el núcleo de una célula somática y usarla para reemplazar el núcleo de un óvulo fertilizado (las llamadas células somáticas de transferencia nuclear). Los factores que quedaban en el huevo podrían reprogramar el núcleo somático como la reconstitución del huevo desarrollado dentro de un embrión humano temprano. Los epiblastos de este embrión pueden ser utilizados para establecer células madre embrionarias "personalizadas" que serían inmunológicamente compatibles con el donante de células somáticas. Tal vez, no es sorprendente que las dificultades técnicas y las complejidades éticas de este enfoque lo haya hecho impracticable.
Los primeros y más importantes avances vinieron de los laboratorios del Dr. Shinya Yamanaka de la Universidad de Kioto en Japón y, más recientemente, del grupo de Thomson, quien muestra que los fibroblastos humanos y de ratón pueden ser reprogramados en células similares a las células madre embrionarias mediante la introducción de combinaciones de factores de transcripción (como el Oct4, Sox2, Klf4, Nanog, Lin28 y c-Myc), los cuales normalmente se expresan en las células madre embrionarias. Ellos concluyeron que estas unidades son pluripotentes, pero la pregunta se sigue manteniendo: ¿pueden diferenciarse en células somáticas funcionales y ser utilizas para terapia celular?
En un experimento con un modelo de ratón adaptado para la anemia drepanocítica humana, J. Hanna y colaboradores ya habían demostrado que esos animales podrían ser rescatados después del trasplante mediante el uso de progenitores hematopoyéticos derivados in vitro de células madre autólogas pluripotentes inducidas (figura 1). En primer lugar, las células madre pluripotentes inducidas se hicieron desde un ratón enfermo de células falciformes, y la mutación falciforme (beta S) se corrigió por medio de la recombinación homóloga convencional. Luego, las células madre pluripotentes inducidas reparadas se diferenciaron en unidades similares a las células madre hematopoyéticas y transfectadas con HoxB4, las cuales ya habían demostrado conferir poder para injertarse en las unidades hematopoyéticas derivadas de células embrionarias. Por último, estas células transfectadas fueron transplantadas de nuevo en tres ratones isogénicos con anemia de células falciformes. La estabilidad del injerto originó sangre que contenía aproximadamente un 70% de células derivadas de células madre pluripotentes inducidas y corregidas, y un 30% de células hematopoyéticas endógenas. Además, se corrigieron los glóbulos anómalos, la anemia hemolítica y las patológicas asociadas.
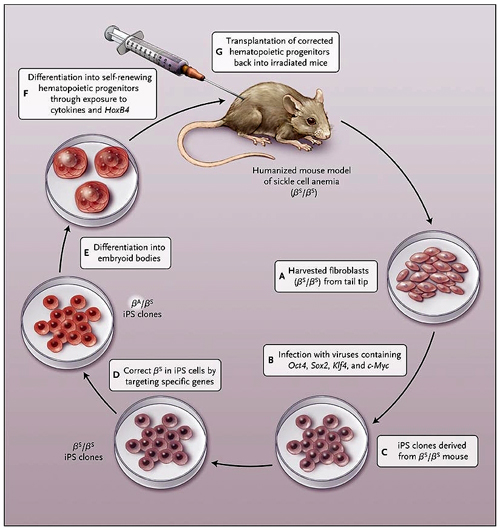
Jacob Hanna y colaboradores recientemente describieron como inducir células madre pluripotentes. En este caso, mediante un modelo murino para la enfermedad de células falciformes, éstas podrían ser reparadas y ser utilizadas en la terapia celular para curar la enfermedad. El proceso consiste en cuatro pasos: la reprogramación de los fibroblastos mutantes donados con la mutación falciforme (beta S) dentro de células madre pluripotentes inducida (células iPS) (A, B, y C), la reparación del defecto genético a través de recombinación homóloga con el alelo tipo salvaje (beta A) (D), la diferenciación in vitro de las células madre pluripotentes inducidas y reparadas dentro de progenitores hematopoyéticos (E y F), y su trasplante en ratones afectados por irradiación (G). El modelo permitió corregir todas las anormalidades clínicas y hematológicas en los animales con enfermedad de células falciformes.
Este es un avance muy excitante para el tratamiento de trastornos monogenéticos, como la anemia de células falciformes y, en general, para el desarrollo de la terapia celular. Sin embargo, aún existen muchos problemas por resolver antes de que las células madre pluripotentes inducidas puedan utilizarse en ensayos con seres humanos. Por ejemplo, la reprogramación de las células madre utilizadas en estos experimentos no son el equivalente a las de origen natural, a largo plazo la evidencia ha demostrado que la repoblación de las células madre hematopoyéticas utilizadas actualmente en la práctica clínica no podrá restablecer plenamente todos los linajes de células sanguíneas maduras. Posteriormente, será necesario desarrollar protocolos contundentes y fiables para realizar la diferenciación de las células madre pluripotentes inducidas humanas en células funcionales para la terapia celular. Además, queda por ver si la recombinación homóloga, paso crítico y necesario para corregir cualquier defecto molecular, pueda ser lograda en células madre pluripotentes inducidas humanas.
Por último, hay muchas cuestiones que se tienen que superar con respecto a la seguridad, principalmente en relación con el potencial de las células madre pluripotentes inducidas a convertirse en células malignas. Sin duda, ya se están elaborando nuevos alcances para modificar los métodos utilizados en la generación de células madre pluripotentes inducidas, en particular aquellos que eviten el uso prolongado de oncogenes como el c-Myc y sustituir la utilización de retrovirus que causan mutagénesis de inserción, un problema que ha complicado la terapia génica en humanos. Incluso, si se pudieran alcanzar estos objetivos, se tendría que estar seguro de que la transcripción y los programas epigenéticos no han sido incorrectamente reprogramados y puedan predisponer a la transformación maligna. Con estas importantes salvedades, existen buenas razones para ser optimistas. Este es un paso hacia adelante fundamental en el tratamiento de la enfermedad genética y en la medicina regenerativa.
Fuente bibliográfica
A New Dawn for Stem-Cell Therapy
Douglas R. Higgs, M.D., D.Sc.
Weatherall Institute of Molecular Medicine, Medical Research Council Molecular Haematology Unit, John Radcliffe Hospital, Oxford, United Kingdom
N Engl J Med. 2008 Feb 28;358(9):964-6


